ヴァン デル ワールス軍とロンドン分散軍
ファン デル ワールス力は、双極子間相互作用によって発生する分子間力の一種です。ロンドン分散力は、非極性分子で優勢なファン デル ワールス力のサブタイプです。分子間力は、2 つの異なる分子間で発生する力です。
これらの力はすべて、イオン結合と共有結合の両方よりも弱いです。それらは短距離でも作用し、分子同士が離れているほど弱くなります。
以下では、一般的なファン デル ワールス軍とロンドン分散軍の両方について掘り下げます。
ファン デル ワールス軍とは?
ファン デル ワールス力は、一時的または永久的な双極子によって発生する分子間の弱い力です。それらは分散力とも呼ばれます。双極子 (一時的または永続的) は、分子間に引力を引き起こします。
ファン デル ワールス力には、ロンドン分散力 (以下で説明)、双極子間力、およびイオン双極子が含まれます。これらの中で最も強い力はイオン-双極子であり、その後に双極子-双極子が続きます。ロンドンの分散勢力は最も弱い勢力です。
すべての分子は、ロンドン分散力を受けます。ただし、非極性分子に存在する唯一の分子間力 (IMF) です。極性分子では、他の IMF が支配的であるため、ロンドン分散力は存在しますが、言及されていない可能性があります。
ファン デル ワールス相互作用は、ヨハネス ディデリク ファン デル ワールスにちなんで名付けられました。ファン デル ワールスは、特定の分子の特性の理由として分子間力を最初に提案しました。
ロンドン分散部隊
ロンドン分散力は、一時的な双極子により 2 つの分子間に発生します。この力は、一時的な双極子を引き起こす電子の不均一な分布によって発生します。平均して、電子は均等に分布していますが、どのような場合でも、分子の片側に集まっている可能性があります。このクラスター化により、瞬間的な双極子が発生します。瞬時双極子は、周囲の分子に一時的な双極子を形成する可能性があります。次に、各分子の双極子が互いに力を及ぼします。
これは最も弱いタイプの分子間力です。
分子の周りの電子雲が大きいほど、瞬間双極子が強くなり、したがって引力が大きくなります。これは、ハロゲンの融点と沸点の傾向に見られます。
| ハロゲン | 融点 (K) |
| F2 | 53.5 |
| Cl2 | 171.6 |
| Br2 | 265.9 |
| I2 | 386.8 |
分子の電子雲のサイズが大きくなる (周期表の行が下に移動する) と、融点が上昇します。融点の上昇は、分子間で壊さなければならないより強い力を示しています。
引力は、コンパクトな分子よりも長く広がった分子でも強くなります。広がった分子は分極率が高く、周囲の分子と接触します。
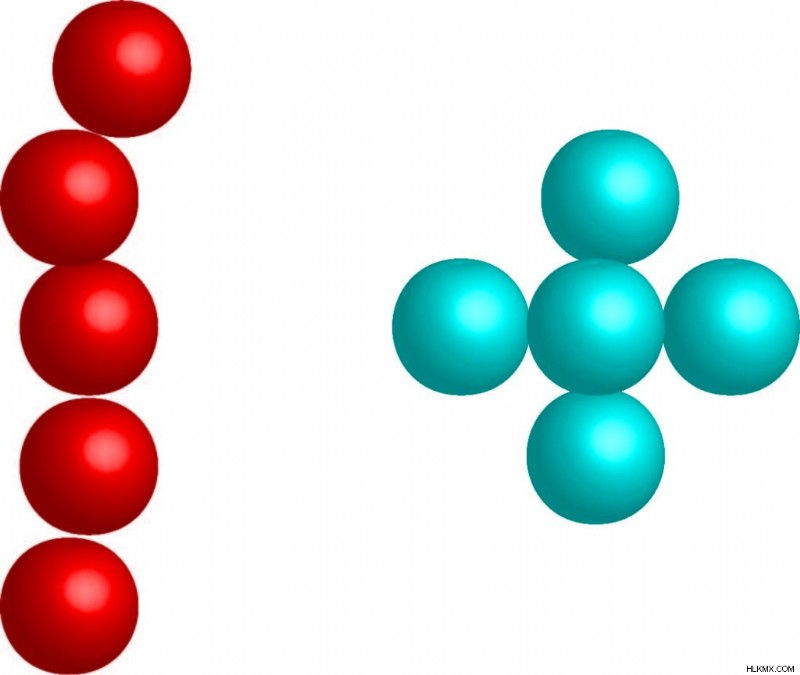
赤い分子は、同じ数の原子を持つコンパクトな青い分子と比較して、その長さのために、より強いロンドン分散力を持ちます。長さが長いということは、電子が移動してより強力な双極子を作成する距離が長くなることを意味します。
室温で液体である非極性分子があるため、これらの力が存在する必要があることがわかっています。それらの間に分子間力がない場合、それらは気体になります。
問題例
IMF 力が大きいのは、臭素とフッ素のどちらの分子ですか?
正解は臭素です。どちらの分子も無極性であるため、主な IMF はロンドン分散力です。臭素は、フッ素よりも多くの電子を持っているため、分極率が高くなります。
どの分子がより大きなロンドン分散力を持つか:メタン (CH4 ) またはヘキサン (C6 H14 )?
ヘキサンが正解です。ヘキサンは、分子が (原子に関して) より大きく、より広がっている (より分極化する可能性がある) ため、より大きなロンドン分散力を持ちます。
ファン デル ワールスの方程式
ファン デル ワールス方程式は、弱い分子間力を考慮して理想気体の法則を修正します。分子間力は an/V を追加することで修正されます 圧力用語に。もう 1 つの補正項は、分子の体積を考慮したものです
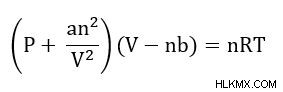
- P =プレッシャー
- V =ボリューム
- n =ガスのモル数
- R=理想気体定数
- T =温度
- a =ガス定数補正係数 (各ガスに固有)
- b=サイズのガス定数補正係数
ロンドン分散軍の歴史
ロンドン分散力は、ドイツの物理学者フリッツ・ロンドン (1900-1954) にちなんで名付けられました。 1933年にドイツを離れ、オックスフォード大学に進学。その後、1939 年にデューク大学の職に就きました。そこでは、量子力学の発展にも大きく貢献しました。