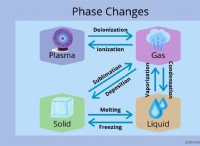
その理由は次のとおりです。
* イオン結合 金属と非金属の間に形成され、1つの原子は電子(正のイオンを形成する)を失い、もう1つは電子(負のイオンを形成する)を獲得します。
* 共有結合 電子を共有する2つの非金属の間に形成されます。
水酸化物の場合:
* 酸素 非金属であり、水素よりも電気陰性です。
* 水素 また、非金属ですが、酸素よりも電気陰性が少ないです。
* 電気陰性の違い 共有電子をそれ自体に近づける酸素につながり、その結果、酸素の部分的な負電荷と水素に部分的な正電荷が生じます。
*この不均一な電子の共有は、OH分子内に極性共有結合を作成します。
*ただし、全体的な電荷 水酸化物イオンのイオンは-1です。この負電荷は、酸素および水素原子にわたって非局在化されています。
したがって、OH分子内の結合は共有結合ですが、水酸化物イオンと他のイオン間の全体的な相互作用はイオンです 。