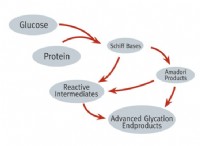
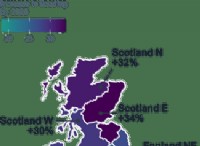
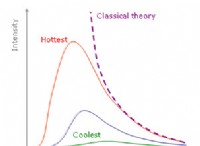
1。結合強度:
* hcl: 水素と塩素の結合は比較的弱いです。これは、塩素が水素よりもはるかに電気陰性であるため、それ自体に近い結合に共有電子を引っ張ることを意味します。これにより、結合が弱まり、水素イオン(H⁺)が解離しやすくなります。
* ch₃cooh: 酢酸中の水素と酸素の間の結合は強いです。酸素も水素よりも電気陰性ですが、結合はカルボン群(COOH)の炭素と酸素原子の存在によってさらに強化されます。
2。コンジュゲートベースの安定性:
* hcl: HClが解離すると、塩化物イオン(Cl⁻)を形成します。塩化物イオンは非常に安定しています。なぜなら、塩素は非常に電気陰性であり、マイナス電荷を効果的に保持しているからです。
* ch₃cooh: 酢酸が解離すると、酢酸イオン(Ch₃COO⁻)を形成します。酢酸イオンの負電荷は、共鳴のために両方の酸素原子にわたって非局在化されています。これはある程度の安定化を提供しますが、塩化物イオンの完全な負電荷ほど効果的ではありません。
3。誘導効果:
* ch₃cooh: 酢酸中のメチル基(Ch₃)は、電子誘導誘導効果を持っています。これは、カルボキシル基に向かって電子密度を押し進め、O-H結合をわずかに弱め、プロトンが解離することをより困難にすることを意味します。
要約:
* hcl: 強い結合、非常に安定したコンジュゲートベース、その結果、h⁺イオンが容易に放出されます。
* ch₃cooh: より弱い結合、安定性の低いコンジュゲートベース、および電子誘導効果により、h "イオンを放出する可能性が低くなります。
したがって、塩酸は酢酸よりもはるかに強い酸です。