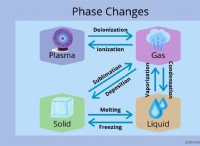
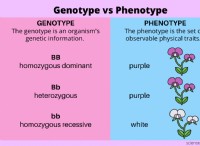
* 電子構成: Boronには[He]2S²2p¹の電子構成があり、シリコンには3S²3p²があります。 どちらも3つの価電子を持っていますが、主要な量子数の違い(ホウ素の場合は2、シリコンの場合は3)は、原子サイズと電気陰性度に有意差をつけます。
* 原子サイズ: シリコンはホウ素よりもかなり大きいです。この大きなサイズは、結合の長さ、結合強度、および反応性に影響します。
* 電気陰性度: シリコンはホウ素よりも電気陰性が少ない。これは、シリコンが結合中に電子を引き付ける可能性が低く、その結合挙動と化学反応性に影響を与える可能性が低いことを意味します。
* 酸化状態: ホウ素は一般に+3酸化状態で化合物を形成しますが、シリコンは+2、 +4、さらには-4の酸化状態で存在します。
* 結合挙動: ホウ素は主に共有結合を形成し、しばしば電子欠損化合物を形成します。シリコンは、共有結合とイオン結合の両方を形成できます。
* 水素化物: ホウ素は、異常な結合を示すジボラン(b₂h₆)のような複雑な水素化物を形成します。シリコンは、シラン(SIH)のような単純な水素化物を形成します。
ここに化学的特性の重要な違いがあります:
* 酸化物の酸性度: 酸化ホウ帯(b₂o₃)は酸性ですが、二酸化シリコン(SIO₂)は両性です(酸または塩基として作用できます)。
* 水との反応性: ホウ素は水と比較的反応しませんが、シリコンはお湯と反応して珪化酸を形成します。
* ハロゲン化物の形成: ホウ素はトリフッ化ホウ素(bf₃)のようなトリハリドを形成しますが、シリコンは四塩化シリコン(sicl₄)のような四重葉を形成します。
要約:
ホウ素とシリコンは周期表で同じグループを共有していますが、原子サイズ、電気陰性度、電子構成の違いにより、化学的特性は大きく異なります。