主な違い - 反応物と生成物
反応物と生成物は、化学反応の 2 つの主要な構成要素です。反応物は、化学反応の出発物質です。生成物は、反応の完了後に見つけることができる化学種です。化学反応には、酸塩基反応、酸化還元反応、燃焼反応など、さまざまな種類があります。したがって、同じ反応物でも、関与する反応のタイプに応じて異なる生成物が得られることがあります。主な違い 反応物と生成物の間にあるのは、反応物は反応全体で消費されるのに対し、生成物は反応から形成されるということです。
対象となる主な分野
1.反応物とは
– 定義、特性、反応の種類とその反応物
2.製品とは
– 定義、特性、反応の種類とその生成物
3.反応物と製品の類似点は何ですか
– 共通機能の概要
4.反応物と製品の違いは何ですか
– 主な違いの比較
重要な用語:酸塩基反応、燃焼反応、分解反応、吸熱反応、発熱反応、沈殿反応、生成物、反応物、レドックス反応、合成反応
反応物とは
反応物は、化学反応の出発物質として機能する化学種です。反応物は、化学反応の進行中に消費されます。反応の最後に、反応混合物に反応物がまったく存在しない場合がありますが、反応物の一部が最後に存在する場合があります。
反応物は無色またはカラフルです。反応の種類と条件に応じて、最終的に無色またはカラフルな生成物が得られます。化学反応の反応物は、固相、液相、または気相に存在する可能性があります。反応の種類に応じて、反応物は異なります。
反応と反応物の種類
酸塩基反応
これらの反応の反応物は酸と塩基です。
酸化還元反応
反応物は酸化剤と還元剤です。場合によっては、反応混合物の pH を維持するために緩衝液も使用されます。
合成反応
合成反応の反応物は、その生成物よりも小さい分子です。
分解反応
分解反応では、反応物はその反応の生成物よりも大きな分子です。
燃焼反応
燃焼反応の反応物は、非常に可燃性の化学種です。
沈殿反応
ほとんどの場合、沈殿反応の反応物は液体です。
発熱反応
これらの化学反応の反応物は、生成物よりも高い位置エネルギーを持っています。
吸熱反応
これらの反応の反応物は、生成物よりも低いポテンシャル エネルギーを持っています。
反応速度は反応物の影響も受けます。特定の反応の速度は、反応物のポテンシャル エネルギーに依存します。
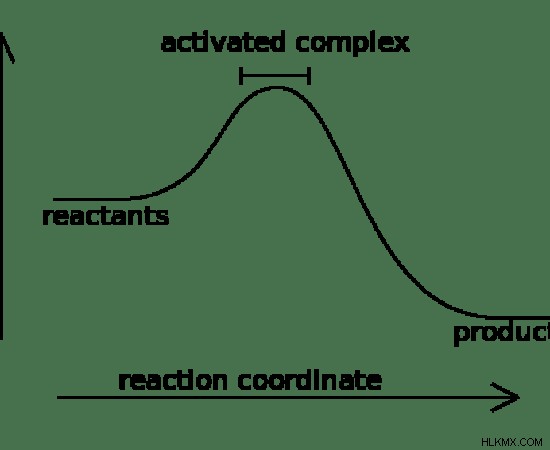
図 01:発熱化学反応の反応座標図
上の画像は、特定の化学反応の反応座標図を示しています。この反応では、反応物は生成物よりも高い位置エネルギーを持っています。したがって、この反応の進行中に、過剰なエネルギーが周囲に放出されます。
製品とは
製品は、化学反応の結果として形成される物質です。これらの生成物は、イオンまたは分子のいずれかです。特定の化学反応の生成物は、固相、液相、または気相で発生する可能性があります。
商品は無色またはカラフルです。生成物の色は、反応に関与する反応物の種類によって異なります。反応混合物中に存在する生成物の量は、反応の進行とともに常に増加します。
反応の種類とその生成物
酸塩基反応
これらの反応の生成物は常に塩と水です。
酸化還元反応
生成物は酸化され、還元された形の反応物になります。多くの場合、水は製品として与えられます。
合成反応
合成反応の生成物は、反応物よりも大きな分子です。
分解反応
分解反応では、生成物は反応物よりも小さい分子です。
燃焼反応
燃焼反応の生成物は、多くの場合、(炭化水素の) 完全燃焼では二酸化炭素と水、不完全燃焼では一酸化炭素です。
沈殿反応
沈殿反応の生成物は、固体の沈殿物または懸濁液です。
発熱反応
これらの化学反応の生成物は、反応物よりも低い位置エネルギーを持っています。
吸熱反応
これらの反応の生成物は、反応物よりも高いポテンシャル エネルギーを持っています。
反応速度は、特定の期間に形成される生成物の量によって決定できます。ほとんどの場合、生成物は安定した形の反応物です。反応物は、安定状態を得るために化学反応を起こします。
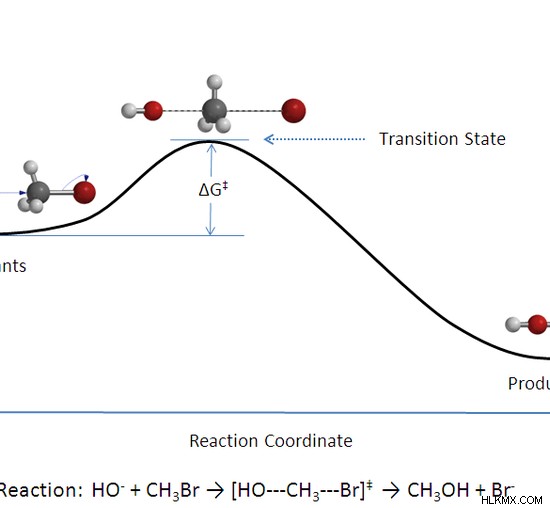
図 02:メチルアルコール生成の反応配位図
上図の反応混合物は、最初は反応物のみで構成され、その後、反応物の遷移状態である中間生成物があり、その後、最終製品が形成されます。この特定の反応では、反応物は生成物よりも高い位置エネルギーを持っているため、エネルギーは熱として放出されます。しかし、このエネルギーは物質ではないため、化学反応の産物とは見なされません。
反応物と生成物の類似点
- 反応物と生成物は、原子、イオン、または分子です。
- 反応物と生成物の両方が反応混合物に存在します。
- 反応物と生成物を使用して、化学反応の速度を決定できます。
反応物と製品の違い
定義
反応物: 反応物は、化学反応の出発物質として機能する化学種です。
製品: 製品は、化学反応の結果として形成される物質です。
消費
反応物: 反応物は反応全体で消費されます。
製品: 生成物は反応で消費されません。
集中力
反応物: 反応混合物中に存在する反応物質の量は、反応中に急速またはゆっくりと減少します。
製品: 反応混合物中に存在する生成物の量は、反応中に急速またはゆっくりと増加します。
始まり
反応物: 反応の開始時、反応混合物には反応物のみが存在します。
製品: 反応の開始時には、生成物は反応混合物に存在しません。
終わり
反応物: 反応の終わりに、反応物が反応混合物中に存在する場合と存在しない場合があります。
製品: 反応の終わりに、生成物が反応混合物に存在します。
結論
反応物と生成物は、化学反応の不可欠な構成要素です。反応物は互いに反応し、主要な生成物と副生成物が生じます。ただし、反応物は化学量論に従ってのみ反応します。特定の反応物の量が、他の反応物と完全に反応するには不十分な場合があります。その場合、両方の生成物と過剰な反応物の一部が反応の最後に存在します。ただし、ここでは、残りの反応物は、反応の結果として形成されないため、反応の生成物とは見なされません。したがって、反応物と生成物の違いを理解することは非常に重要です。
参照:
1. ヘルメンスティン博士アン・マリー。 「化学における生成物とは何か?定義と例。ソートカンパニーN.p.、n.d.ウェブ。こちらから入手できます。 2017 年 7 月 13 日.
2.ライブラリテキスト。 「化学反応の速度。」化学LibreTexts。 Libretexts、2016 年 7 月 21 日。ウェブ。こちらから入手できます。 2017 年 7 月 13 日。
画像提供:
1. ユーザーによる「Ac com」:Slashme – Commons Wikimedia 経由で en:Image:Ac_com.png (パブリック ドメイン) から再描画
2. 「Rxn 座標図 5」Chem540grp1f08 著 – Commons Wikimedia による自身の作品 (CC BY-SA 3.0)