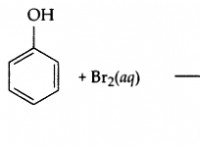
これがバランスの取れた化学式です:
ch₃cooh(aq) +nh₄oh(aq)⇌ch₃coonh₄(aq) +h₂o(l)
説明:
* 酢酸(Ch₃COOH) 弱酸です。つまり、溶液中に完全にイオン化しないことを意味します。プロトン(H⁺)を寄付します。
* 水酸化アンモニウム(nh₄oh) 弱いベースです。つまり、溶液中に完全にイオン化しないことを意味します。プロトン(H⁺)を受け入れます。
*これら2つが反応すると、酢酸からのプロトンは水酸化アンモニウム分子に移動します。
*これにより、酢酸アンモニウム(ch₃coonh₄)の形成が生じます 、塩、および水(h₂o) 。
重要な注意: 水酸化アンモニウムは、実際にはアンモニア(NH₃)と水と平衡状態にあります。
nh₃(aq) +h₂o(l)⇌nh₄⁺(aq) +oh⁻(aq)
したがって、反応は次のように書くこともできます。
ch₃cooh(aq) +nh₃(aq) +h₂o(l)
反応は可逆的であるため、両方向に進むことができます。ただし、酢酸アンモニウムと水の形成が好まれています。