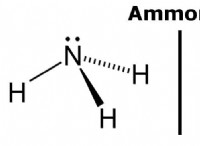
その理由は次のとおりです。
* 電気陰性度: 原子には、電子を引き付ける能力が異なります。これは電気陰性度と呼ばれます。 電気陰性度が高いほど、共有電子の引きが強くなります。
* 極性共有結合: 異なる電気陰性度を持つ2つの原子が結合を形成する場合、電子はより高い電気陰性度で原子に向かってより強く引っ張られます。これにより、極性共有結合が作成されます 、結合の一方の端はわずかに負の電荷(Δ-)を持ち、もう一方の端にはわずかに正電荷(Δ+)があります。
* 非極性共有結合: 2つの原子が同じ電気陰性度(または非常に類似した)を持っている場合、それらは電子を均等に共有します。これにより、非極性共有結合が作成されます 。
例:
* 極性共有結合: 水分子(H₂O)では、酸素は水素よりも電気陰性です。共有電子は酸素に向かってさらに引っ張られ、酸素原子にわずかに負の電荷と水素原子にわずかに正電荷を生成します。
* 非極性共有結合: メタン分子(Ch₄)では、炭素と水素は同様の電気陰性度を持っています。電子は原子間で均等に共有され、非極性結合が生じます。
要約:
* 非極性共有結合 電子の平等な共有を伴います。
* 極性共有結合 電子の不平等な共有を伴い、分子内に部分的な正と負電荷を作成します。