コア コンセプト
このチュートリアルでは、共通イオン効果について紹介します .それが何であるか、それがどのように機能するか、そして化学反応と現実世界の両方における溶解度と沈殿物への全体的な影響について学びます.
他の記事で取り上げるトピック
- ル・シャトリエの原則
- 平衡定数
- ルイス酸と塩基
- 酸塩基理論
- 緩衝液
- pHとは?
共通イオン効果とは?
まず、共通イオンとは ?水酸化亜鉛の溶液があり、亜鉛イオンが溶液に加えられたとしましょう.亜鉛イオンは溶液と追加される塩の両方に含まれているため、この例では亜鉛イオンが一般的なイオンになります。
共通イオン効果は、物質の溶解平衡に対するイオンの効果を表します。一般的なイオンからなる可溶性化合物を添加すると、溶液内のそのイオンの濃度を下げることができます。これにより、溶液の平衡点が変化する可能性があります。これは、塩などの弱い電解質の溶解度を分析するときに見られます。
これは、イオンの結合または解離能力に関するル シャトリエの原理の概念の結果です。ル シャトリエの原理に関するチュートリアルを読んで、さらに詳しく学んでください!
溶解度への影響
共通イオンの追加
塩を含む溶液があり、(塩の) 共通イオンが追加されると、塩が沈殿します。個々のイオンの濃度は、塩の沈殿物を作成するために使用されるため、減少します。溶解平衡に達するまで、イオンの濃度は減少し続けます。
一般的なイオン定義の例を使用すると、これは水酸化亜鉛溶液に亜鉛イオンを追加するようなものです。共通のイオンは亜鉛です。
共通イオンを含む溶液の追加
共通イオンを含む溶液を追加すると、共通イオン自体を追加するのと同じ効果が溶解度に与えられます。入ってくる溶液は解離し、塩の沈殿が増加し、イオン濃度が低下します。入ってくる溶液中の他のイオンは、通常、溶解平衡に大きな影響を与えません.
一般的なイオン定義の例を使用すると、これは水酸化ナトリウムを水酸化亜鉛溶液に追加するようなものです。一般的なイオンは水酸化物です。
緩衝液における共通イオン効果
緩衝液に共役イオンを加えるとpHが変化します。共通イオン効果がこの変化の原因です。
強力な電解質 (つまり、その共役塩基塩) を加えて溶解した酸性緩衝液について考えてみましょう。電解質は解離し、一般的なイオンと酸を部分的にイオン化するイオンの両方を生成します。生成された共通イオンは、酸のイオン化を打ち消します。ルシャトリエの原理により、平衡は反応物に有利にシフトします (左側)。酸のイオン化 (および解離) が減少するため、pH が上昇します。
共通イオン効果の実例
水処理
水が地下で発見されると、天然物質(岩石など)と混合されます。したがって、石灰岩またはチョークが含まれている場合があります。非常に溶けやすい炭酸ナトリウムを加えて、水の硬度、またはカルシウムとマグネシウムのレベルを下げることができます。これにより、あまり溶けない炭酸カルシウムが生成されます。
次に炭酸ナトリウムをさらに加える。この場合、炭酸塩が共通イオンになります。この添加により、水溶液から炭酸カルシウムが沈殿する。ここで水処理について詳しく読んでください!

共通イオン効果の例
硫酸カルシウムの溶液を例に取りましょう。飽和溶液では、硫酸カルシウムはカルシウムイオンと硫酸イオンと平衡状態にあります。硫酸カルシウムの大部分は分子として残りますが、ごく一部がイオンに解離します。
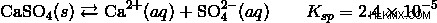
この飽和溶液に塩化カルシウムを加えましょう。この場合、溶液中のカルシウムイオンの濃度が高くなります。 [Ca]×[SO4]の積 ] も増加し、一時的に Ksp よりも大きくなります。上記の平衡は、ル シャトリエの原理によると、追加されたカルシウム イオンのために左にシフトします。イオン積が再び Ksp に等しくなるまで、より多くの硫酸カルシウムが溶液から沈殿します。再び平衡に達すると、カルシウム イオンと硫酸イオンの濃度は互いに等しくなくなることに注意してください。カルシウム イオン濃度ははるかに高くなりますが、濃度の積は依然として Ksp に等しくなります。
これは共通イオン効果の好例です。硫酸カルシウムの飽和溶液に塩化カルシウムを添加すると、追加の硫酸カルシウムが溶液から沈殿し、有効溶解度が低下します。硫酸ナトリウムなどの硫酸イオンを含む化合物または溶液を添加すると、同様の効果が得られます。
さらに読む
- 利回りの計算
- 重量パーセントの計算
- ニューマン プロジェクション
- ヘスの法則







