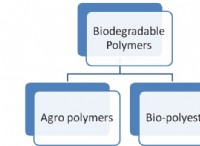
これが故障です:
* brønsted-lowry理論 酸をプロトンドナーとして定義します プロトンアクセプターとしてのベース 。
これを例で説明しましょう。
* hcl(塩酸) プロトン(H+)を水(H2O)に水素イオン(H3O+)と塩化物イオン(CL-)を形成します。
* NH3(アンモニア) アンモニウムイオン(NH4+)と水酸化物イオン(OH-)を形成する水(H2O)からのプロトン(H+)を受け入れます。
対照的に、Arrhenius理論のような他の定義は、塩基による水酸化物イオン(OH-)の形成と酸による水素イオン(H+)の形成に焦点を当てています。 有用ですが、Arrhenius理論は水溶液に限定されています。 一方、Brønsted-Lowry理論はより一般的であり、より広い範囲の反応に適用できます。