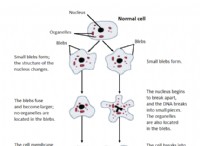
その理由は次のとおりです。
* イオン結合: Kiとcai₂はどちらもイオン化合物であり、積極的に帯電した陽イオン(k⁺またはca²⁺)と負に帯電した陰イオン(i⁻)の間の静電力によって一緒に保持されています。
* 格子エネルギー: イオン結合の強度は、1モルのイオン結晶をその気体イオンに分解するために必要なエネルギーである格子エネルギーによって決定されます。
* 格子エネルギーに影響する要因:
* チャージ: イオン上のより高い電荷は、より強力な静電魅力と格子エネルギーが高くなります。
* サイズ: より小さなイオンは電荷密度が高いため、より強いアトラクションと格子エネルギーが高くなります。
* 比較:
* ki: カリウム(k⁺)には+1充電があり、ヨウ素(i⁻)には-1充電があります。
* cai₂: カルシウム(CA²⁺)には+2電荷があり、ヨウ素(I⁻)には-1電荷があります。
ca²⁺はk⁺よりも高い電荷を持っているため、cau₂ではca²⁺とi⁻の間の静電引力が強くなります。これにより、CAI₂の格子エネルギーが高くなり、結晶構造を分解することがより困難になるため、より高い融点が必要になります。
要約すると、カルシウム陽イオンの電荷が高いため、Cai₂は格子エネルギーが高く、KI。