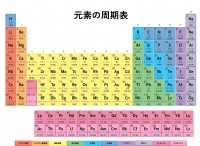
電子構成とaufbau原理
* 電子はエネルギーレベルを占めます: 原子には、核の周りに異なるエネルギーレベルに存在する電子があります。 これらのレベルは、電子の「シェル」または「層」と考えてください。
* レベル内の軌道: 各エネルギーレベル内に、電子が最も見られる可能性が最も高い軌道と呼ばれるスペースの特定の領域があります。これらの軌道は異なる形状(S、P、D、F)を持ち、それぞれ最大2つの電子を保持できます。
* aufbau原則: この原則は、電子がエネルギーを増やす順に軌道を満たすことを示しています。 これは、より高い床に行く前に最初に最低階が満たされる建築プロセスのようなものです。
なぜ最初にエネルギーレベルが低いのか?
* 安定性: 電子は、自然に可能な限り低いエネルギー状態になりたいと考えています。それは丘を転がり落ちるボールのようなもので、最も安定している最低点を求めています。
* 反発の最小化: 電子は負に帯電し、互いに反発します。より低いエネルギーレベルを最初に埋めることにより、それらはさらに離れて間隔を置き、この反発を減らします。
例:
7つの電子を持つ元素窒素(N)を考えてみましょう。
1。最初のエネルギーレベル(n =1): このレベルには、サブシェルが1つしかありません。1S軌道です。最大2つの電子を保持できます。したがって、窒素の最初の2つの電子が1S軌道を満たします。
2。 2番目のエネルギーレベル(n =2): このレベルには、2S軌道と2p軌道の2つのサブシェルがあります。
* 2s軌道は2つの電子を保持できるため、次の2つの電子がこの軌道を満たします。
* 2p軌道は最大6つの電子(3つの軌道、それぞれ2つの電子を保持)を保持できます。残りの3つの電子の窒素は2p軌道を満たします。
したがって、窒素の電子構成は1S²2S²2p³。です
キーポイント:
* 常に完全なルールではありません: Aufbauの原則は一般的なガイドラインを提供しますが、電子間の複雑な相互作用のために、より高い原子数を持ついくつかの要素には例外があります。
* エネルギーレベル図: 図は、軌道の充填順序を視覚化するのに役立ちます。 これらの図は、軌道の相対エネルギーレベルを示しています。
電子構成またはaufbau原則について他に質問がある場合はお知らせください。