主な違い - 原子価と原子価電子
Valency と Valence Electrons という 2 つの用語は互いに非常に密接に関連していますが、両者には微妙な違いがあります。 「原子価」は、化学におけるその文学的な意味により、容量に関連しています。化学用語では、元素の原子価は、それが形成できる結合の数です。価電子は、この結合に参加できる電子です。したがって、主な違い 原子価とは、原子または元素によって形成できる結合の数です。 価電子は この結合形成に関与する電子。
ヴァレンシーとは
IUPAC の定義によると、原子価とは「検討中の元素の原子、またはフラグメント、またはこの要素の原子を置換できる」.一度に 1 つの電子とペアになるため、ここでは一価の原子が考慮されていることに注意することが重要です。ただし、2 価の原子である酸素のような元素をこの目的に使用すると、原子価は、結合の形成に関与した酸素の量の 2 倍に等しくなります。
化合物の原子価図は、原子の結合を線で示しますが、これは必ずしも共有電子のペアを表すとは限りません。次のような化学結合に関連する現代の理論につながったのは原子価の概念でした。原子価結合理論、ルイス構造、分子軌道理論、および原子価殻電子対反発理論。主族元素は通常 1 つの原子価を示しますが、遷移金属は複数の原子価で有名です。

原子価結合説:2 つの p 軌道が π 結合を形成。
価電子とは
価電子は結合形成に関与する電子です。それらは通常、主族元素の最外殻に位置し、複数の原子価を持つため、遷移金属の閉じた殻にあることさえあります.また、各元素の化学的特性を定義するのは価電子であり、価電子の数に基づいて周期表の列の下にグループ化されます。
希ガス (不活性) 電子配置を形成するのに必要な数よりも多い 1 つまたは 2 つの価電子を持つ原子は、より多くの価電子を持つ原子と比較すると、非常に反応性が高くなります。外殻。たとえば、元素が希ガスの電子配置を実現するために電子を放出する必要がある場合、核引力に逆らってより多くの電子を除去するよりも、1 つまたは 2 つの電子を除去する方が簡単です。希ガス構成を達成するために電子を受け入れる必要がある場合も同様です。この場合、強い電気陰性度の影響下では、多くの電子よりも少数の電子を受け入れる方が簡単です。また、価電子は元素の最外殻にあるため、エネルギーの光子を吸収してより高いエネルギー準位に励起することができ、同様にエネルギーを放出してより低いエネルギー準位に下げることもできます。酸化の場合、十分な量のエネルギーを吸収する電子は、大量の運動エネルギーのために要素から除去される可能性があります。 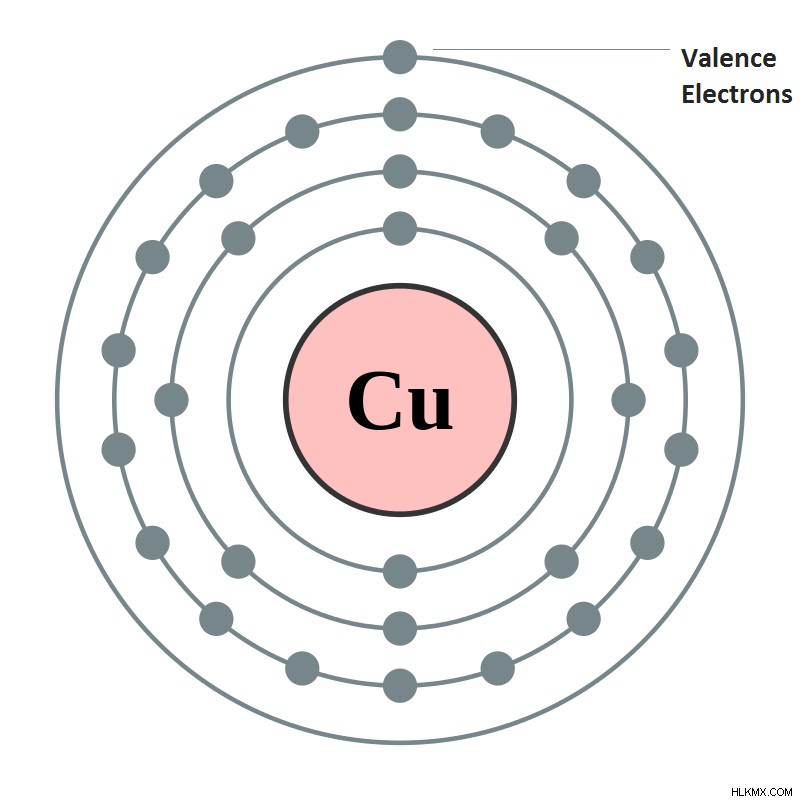
価数と価電子の違い
定義
価数 原子/元素の数は、その周りに形成できる結合の数です。
価電子 通常、要素の最も外側のシェルにあり、化学結合の形成に関与します。
理論
価数 原子間の結合の形成を説明します。
価電子 要素のキャラクターにより関連しています。
申し込み
価数 は単なる概念であり、電子遷移は含まれません。
価電子 結合の形成と遷移の化学反応による原子イオンの生成に積極的に関与します。
遷移金属元素への影響
遷移金属は複数の原子価を持つことができます 要素によって異なります。
価電子の数 元素の各状態には一定数の価電子があるため、遷移金属では考慮の点で表されます。