1。電子構成の理解:
* 原子: 原子は物質の構成要素です。それらは、シェルと呼ばれる特定のエネルギーレベルの電子に囲まれた陽子と中性子を含む中央の核を持っています。
* 価電子: 原子内の最も外側の電子は、価電子と呼ばれます。これらは化学結合に関与するものです。
* オクテットルール: ほとんどの原子は、最も外側のシェルに8つの電子を持つように努力しています(2つだけが必要な水素とヘリウムを除く)。これはOctetルールとして知られており、共有結合を理解する上で重要な原則です。
2。電子の共有:
* 非金属: 非金属は一般に、電気陰性度が高い(電子を引き付ける原子の能力の尺度)。彼らは完全な外側のシェルを達成するために電子を獲得する傾向があります。
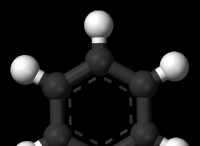
* 共有: 2つの非金属が一緒になったとき、彼らは彼らの原子価電子を共有して外側のシェルを完成させます。この共有は共有結合をもたらします。
* 共有結合: この共有電子のペアは、原子を一緒に保持する両方の核に引き付けられます。
3。共有結合の種類:
* 単一の債券: 単一の共有結合には、1つの電子の共有が含まれます。
* ダブルボンド: 2組の電子が2つの原子間で共有されます。
* トリプルボンド: 3組の電子が2つの原子間で共有されます。
4。共有化合物の例:
* 水(h₂o): 各水素原子は、1つの電子を酸素原子と共有し、2つの単一共有結合を形成します。
* 二酸化炭素(CO₂): 炭素は、各酸素原子と2組の電子を共有し、2つの二重共有結合を形成します。
* メタン(Ch₄): 炭素は、4つの水素原子のそれぞれと1つの電子を共有し、4つの単一共有結合を形成します。
5。共有化合物の特性:
* 融点と沸点の低い: 共有結合はイオン結合よりも弱く、融点と沸点の低下につながります。
* 電気の導体が悪い: 共有化合物は一般に、自由移動帯電粒子を持っていないため、電気を導入しません。
* しばしばガスまたは液体: 共有化合物は、室温でのガスまたは液体である可能性が高くなります。
覚えておくべきキーポイント:
*共有結合は非金属間に形成されます。
*それらは電子の共有を伴います。
*目標は、安定した電子構成(通常はオクテットルール)を達成することです。
*共有化合物には、イオン化合物とは異なるユニークな特性があります。
これ以上質問がある場合はお知らせください!