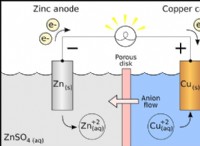
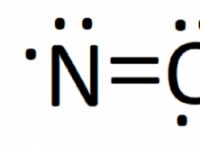1。溶液の加熱:
*溶媒と溶質を含む溶液が加熱されます。
*沸点が低い溶媒は、最初に蒸発します。
2。蒸気コレクション:
*次に、蒸気が収集され、コンデンサーを介してチャネル化されます。
3。凝縮:
*コンデンサーは蒸気を冷却し、液体に凝縮します。
*現在溶媒で濃縮されたこの液体は、個別に収集されます。
4。残留溶質:
*より高い沸点を持つ溶質は、より集中した溶液として元の容器に残ります。
蒸留の種類:
* 単純な蒸留: 大幅に異なる沸点でコンポーネントを分離するのに適しています。
* 分数蒸留: 沸点を備えた混合物に近い。これには、蒸気が凝縮して再蒸発するための追加の表面積を提供する分画カラムが含まれ、より効率的な分離につながります。
例:
* 水(溶媒)から塩(溶質)を分離する(溶質): 水は100°Cで沸騰しますが、塩は沸点がはるかに高くなります。
* エタノール(溶媒)を水から分離(溶質): エタノールは78°Cで沸騰し、水は100°Cで沸騰します。
重要な考慮事項:
* 沸点の違い: 蒸留は、溶媒と溶質の間に沸点に大きな違いがある場合に最適に機能します。
* 圧力: 圧力を下げると、溶媒の沸点が減少すると、分離が容易になります。
* 純度: 分離された成分のより高い純度を達成するには、繰り返される蒸留ステップが必要になる場合があります。
全体として、蒸留は、溶媒から溶媒から溶媒を分離するために蒸発と凝縮の原理に依存する多用途の技術です。 化学、薬局、食料生産など、さまざまな分野の貴重なツールです。