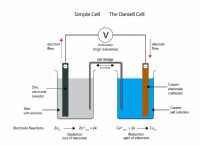
その理由は次のとおりです。
* 酸 通常、pHが7未満で、溶液中の水素イオン(H+)を放出します。
* ベース 通常、pHが7を超え、溶液中の水酸化物イオン(OH-)を放出します。
酸と塩基が反応すると、酸からの水素イオン(H+)が塩基から水酸化物イオン(OH-)と結合して水(H2O)(H2O)を組み合わせます。また、このプロセスは、塩の陽イオンと酸の陰イオンから形成された化合物である塩の形成をもたらすことがよくあります。
中和反応の一般的な方程式は次のとおりです
酸 +ベース→塩 +水
例:
塩酸(HCl) +水酸化ナトリウム(NAOH)→塩化ナトリウム(NaCl) +水(H2O)