1。要素を特定します: イオンとして表現したい要素の中性原子から始めます。
2。イオンの電荷を決定します: 周期表の要素の位置と、電子を獲得または失う傾向を考えてください。
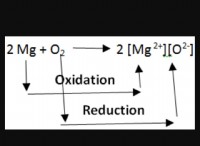
* 金属 一般に、電子を失い、陽イオン(陽イオン)を形成します。
* 非金属 通常、電子を獲得して負イオン(アニオン)を形成します。
3。ニュートラル原子のbohr図を描きます:
*核を表す中央の円を描きます。
*核内に要素のシンボルを書きます。
*電子シェルに対応する核の周りにリング(エネルギーレベル)を描きます。
*各シェルが特定の数の電子を保持できるというルールに従って、電子を表すドットでリングを満たします。
*最初のシェル(n =1):最大2つの電子を保持します
* 2番目のシェル(n =2):最大8電子を保持します
* 3番目のシェル(n =3):最大18電子を保持しますが、多くの場合、簡単にするために最大8個しか満たしません。
4。イオンの変更:
* カチオン: イオンの正電荷に合わせて、最も外側のシェルから適切な数の電子を取り外します。
* アニオン: イオンの負電荷に合わせて、適切な数の電子を最も外側のシェルに追加します。
5。イオンにラベルを付けます: 図の横にある電荷(na+、cl-など)でイオンのシンボルを書きます。
例:塩化物イオン(Cl-)
1。要素: 塩素(CL)
2。電荷: 塩素は1つの電子を獲得して-1電荷(CL-)を形成します。
3。中性塩素図:
* [cl]
*(最初のシェルの2つの電子)
*(2番目のシェルの7つの電子)
4。イオン用に変更:
* [cl-]
*(最初のシェルの2つの電子)
*(2番目のシェルの8つの電子)
注: BOHRモデルは単純化された表現であり、電子の量子機械的性質を完全に反映していません。ただし、電子の構成を視覚化し、原子がイオンを形成する方法を理解するための有用なツールです。