原子の酸化状態が変化するとき、化学プロセスは酸化還元と呼ばれ、次のように定義されます:1 つの種 (還元剤) が酸化を経る (したがって電子を失う) 一方で、別の種 (酸化剤) が還元を経る (したがって電子を得る) (電子を得る) という酸化還元反応のことです。このプロセスは、電子が引き抜かれた化学種を酸化、電子が導入された化学種を還元と呼びます。別の言い方をすれば:
酸化は、分子内の原子、イオン、または特定の原子の電子の損失または酸化状態の上昇として定義されます。システム内の酸素の存在。
原子、イオン、または特定の原子または亜原子粒子は、電子を獲得したり、原子、イオン、またはその酸化状態を低下させたりするときに還元を受けます。特定の原子または亜原子粒子 (酸化状態の減少)。
有機化学における多くの反応は酸化還元反応であり、酸化状態の変化の結果として発生しますが、個別の電子移動は関与しません。これらの反応には次のようなものがあります。たとえば、木材を分子状酸素で燃やすと、木材中の炭素原子の酸化状態が増加し、酸素原子の酸化状態が低下して、二酸化炭素と水が生成されます。酸素原子は還元プロセスを経て正式に電子を獲得しますが、炭素原子は酸化プロセスを経て公式に電子を失います。その結果、酸素はこのプロセスで酸化剤として機能し、炭素は還元剤として機能します。
しかし、酸化反応は一般に酸素分子からの酸化物の生成と関連しているが、他の化学種が酸素と同じ役割を果たすことができるため、酸素はそのような反応に常に存在する必要はない.
酸化
伝統的または以前の酸化の概念では、酸素または電気陰性元素が追加され、水素または電気陽性元素が除去されるプロセスとして定義されています。
電子理論では、酸化は化学反応の結果として原子またはイオンが 1 つまたは複数の電子を失うプロセスと定義されています。
縮小
古典的またはそれ以前の概念によると、還元は、酸素または電気陰性元素の除去だけでなく、水素または電気陽性元素の付加を伴うプロセスです。
電子の概念によると、還元は、1 つの原子またはイオンが別の原子またはイオンから 1 つまたは複数の電子を受け取るプロセスとして説明されます
酸化および還元反応の古典的な概念は次のとおりです:
以下は酸化反応の例です:
1.酸素添加:
C + O2 → CO2 (炭素の酸化)
2.電気陰性元素の追加:
Fe + S → FeS (鉄の酸化)
3.システムからの水素の除去:
H2S + Br2 → 2 HBr + S (硫化物の酸化)
4.陽性要素の除去:
2 KI + H2O2 → I2 + 2 KOH (ヨウ化物の酸化)
酸化剤は、酸化を引き起こす化学物質です。上記の例で使用される酸化剤には、酸素、二酸化硫黄、二酸化塩素、二酸化臭素、および過酸化水素があります。
還元反応には次のステップが含まれます:
1.水素の添加
N2 + 3 H2 → 2NH3 (窒素の還元)
2.陽性要素の追加:
SnCl2 + 2HgCl2 → SnCl4 + Hg2Cl2 (塩化水銀の還元)
3.酸素の除去
ZnO + C → Zn + CO (酸化亜鉛の還元)
4.電気陰性要素の除去
2FeCl3 + H2 → 2FeCl2 + 2HCl (塩化第二鉄の還元)
還元剤は、何かの量を減らす効果を持つ化学物質です。上記の場合、還元剤として H2、HgCl2、および C が使用されます。
電子移動による酸化と還元
原則として、これは酸化と還元の最も一般的に使用され、最も広く適用できる定義です。
この場合、酸化は電子の喪失と定義され、還元は電子の獲得と定義されます。
オイル リグは、このテーマを覚えるのに特に効果的な記憶法です。
OIL RIG、酸化とは物質の損失です。増加は削減によるものです。
酸化反応と還元反応は、本質的に密接に絡み合っています。電子は化学プロセスで生成も破壊もされないため、酸化と還元の反応は常にペアで発生します。したがって、一方を他方なしで持つことは不可能です。次のプロセスを例として使用すると、マグネシウムは酸素に 2 つの電子を与えることによって酸化され、次にマグネシウムから 2 つの電子を吸収することによって還元されます。
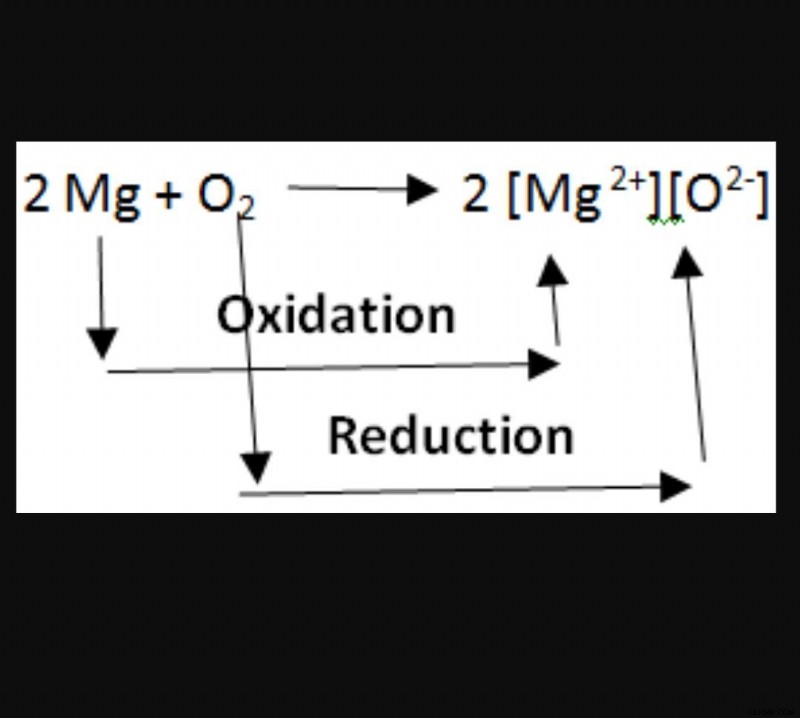
酸化と還元は単独では発生しないため、グループとして発生する場合は「レドックス反応」と呼ばれます。他の反応物を酸化する反応物は酸化剤と呼ばれ、他の反応物を還元する反応物は還元剤と呼ばれます。酸化剤が電子を受け取るか放出するかという問題については、非常に曖昧な点があります。
一般的なレドックス反応
発生する最も一般的な 3 つの酸化還元反応は次のとおりです。
1.燃焼反応 — これは分子状酸素と化学物質の間で起こる酸化還元反応の一種で、酸素を含む生成物が形成されます。
2C8H18+25O2 → 16CO2(g)+18H2O
2.これは、不均化反応として知られている、1 つの反応物だけが還元されてから酸化される酸化還元反応です。自動酸化反応は、この現象の別名です。
3ClO−(aq) → ClO3−(aq)+2Cl−(aq)
3.単一置換反応 (単一置換反応とも呼ばれます) は、分子内で 2 つの要素が移動する酸化還元反応の一種です。単一置換反応は、このタイプの反応の別名です。
Zn(s)+2HCl(aq) → ZnCl2(aq)+H2(g)
結論
酸化と還元という用語は、物質からの酸素の付加または除去としてそれぞれ定義できます。以下で説明するように、これは最も包括的な定義ではありませんが、最も覚えやすいものです。酸化は、酸素を獲得するプロセスです。酸素が失われることを還元といいます。酸化還元反応 (レドックス反応とも呼ばれます) は、自然に発生するか、生物学的に生成され、人工的に生成されるかに関係なく、この惑星の主要なエネルギー源であるため、不可欠です。水素の除去または酸素との結合による分子の酸化は、通常、膨大な量のエネルギーを放出します。