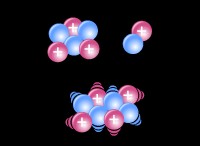
* 電気陰性度: フッ素(F)は、周期表で最も電気陰性の要素です。これは、電子に強い魅力を持っていることを意味します。水素(H)は電気陰性度が低いです。 HとFの電気陰性度の違いは、極性共有結合を作成するのに十分な大きさです。
* 電子の共有: 共有結合では、原子は電子を共有して安定した電子構成を実現します。 HFでは、水素原子はフッ素と単一の電子を共有し、フッ素がオクテットを完成させることができます。
キーポイント:
* イオン化合物 金属原子が電子を非金属原子に失うと、互いに引き付けるイオンが反対に帯電したイオンを形成します。
* 共有化合物 非金属原子が電子を共有して安定した電子構成を実現するときに形を形成します。
HF結合は極性ですが、電子が不均等に共有されているため、依然として共有結合と見なされます。