1。イオン化合物:イオンの海
*イオン化合物は、陽性に帯電したイオン(陽イオン)と、静電力によって一緒に保持されている負に帯電したイオン(陰イオン)で構成されています。
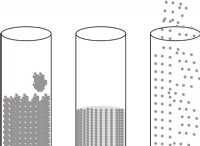
*これらの化合物が水に溶解すると、水分子がイオンを囲み、互いに分離します。このプロセスは解離と呼ばれます 。
2。水:完全な媒体
*水分子は極性です。つまり、わずかに正の末端(水素原子の近く)とわずかに負の端(酸素原子の近く)があります。
*この極性により、水分子はイオン化合物のイオンと相互作用することができます。水分子の正の端は陰性イオンを引き付け、負の端は正のイオンを引き付けます。
3。遊離イオン:導電率の鍵
*イオン化合物が溶解すると、イオンは結晶格子に閉じ込められなくなります。彼らは解決策の中で独立して自由に動き回ることができます。
*これは、イオンのこの移動度です これにより、ソリューションが電気を導入できます。
4。導電率の仕組み
* 電気 荷電粒子の流れです。
*溶液全体に電圧が印加されると、溶液中の遊離イオンが移動します。
* 陽性イオン(陽イオン) 負の電極(カソード)に向かって流れます。
* 負イオン(アニオン) 正の電極(アノード)に向かって流れます。
*荷電粒子のこの動きは、電流を構成します 、およびソリューションは導電性になります。
要約:
*水にイオン化合物を溶解すると、遊離イオンが放出されます。
*これらの遊離イオンは、電界の影響下で移動する可能性があり、溶液が電気を導入できるようにします。
*溶液に存在するイオンが多いほど、導電率が大きくなります。
例:
*テーブル塩(NaCl)は水に溶解してナトリウムイオン(Na+)と塩化物イオン(CL-)を形成し、溶液を導電性します。
*砂糖(C12H22O11)は共有化合物であり、溶解するとイオンに解離しません。したがって、砂糖溶液は電気を導入しません。