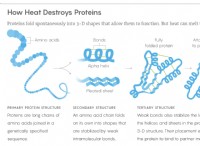
1。衝突頻度の増加:
- 混合すると反応物が近接に近づき、分子間の衝突の可能性を高めます。
- 衝突が多いと、活性化エネルギー障壁を克服するのに十分なエネルギーとの衝突が成功する可能性が高いことを意味します。
2。改善された物質移動:
- 混合すると濃度勾配が減少し、反応ゾーンへの反応物の一貫した供給が確保されます。
- これにより、反応物が反応部位に拡散する速度によって反応が制限されるのを防ぎます。
3。熱伝達の強化:
- 混合は熱の移動を容易にすることができます。これは、発熱(放出熱)または吸熱(吸収熱)の反応に重要です。
- 熱をより均等に分配することにより、混合することで、最適な温度で反応が進行することが保証されます。
例:
2つの固体間の反応を考えてください。それらが互いに隣に配置されているだけの場合、反応は固体が接触している表面でのみ発生します。おそらくそれらを混ぜることでそれらを混ぜると、はるかに大きな表面積が露出し、はるかに速い反応につながります。
例外:
混合が反応速度を増加させない場合がある場合は、いくつかの例外があります。
- 均質反応: 反応物がすでに単相(たとえば、ガスや液体)で均一に分布している場合、混合は大きな影響を与えない場合があります。
- 遅いステップでの反応: 反応速度が混合の影響を受けない遅いステップによって制限されている場合、混合は全体の速度を変えません。
要約すると、混合は一般に衝突頻度を高め、物質移動を改善し、熱伝達を促進することにより反応速度を増加させます。ただし、混合が重要な効果がない場合がある場合は、いくつかの例外があります。