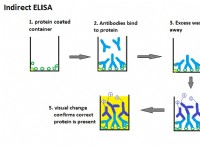
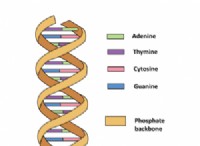
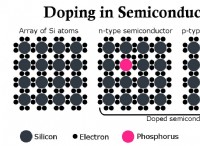
1。固体の性質:
* イオン化合物: テーブル塩(NaCl)や砂糖(スクロース)などのこれらの化合物は、水のような極性溶媒に溶けやすいことがよくあります。固体のイオンは、溶媒分子の反対に帯電した極に引き付けられ、固体を分解して溶液を形成します。
* 極分子: エタノール(C2H5OH)やアセトン(CH3COCH3)などの極性共有結合を持つ化合物は、一般に極性溶媒に溶けます。
* 非極性分子: オイルやグリースなどの非極性共有結合を持つ化合物は、通常、ヘキサンのような非極性溶媒に溶けます。これは、非極性分子間の弱い分子間力により自由に混合できるためです。
2。液体の性質:
* 極性溶媒: 水は最も一般的な例であり、他の極性溶媒にはエタノール、アセトン、メタノールが含まれます。これらの溶媒は極性固形物とイオン化合物を溶解します。
* 非極性溶媒: 例には、ヘキサン、トルエン、ジエチルエーテルが含まれます。これらの溶媒は非極性固形物を溶解します。
3。温度:
*一般的に、より高い温度は、液体のほとんどの固形物の溶解度を高めます。これは、運動エネルギーの増加により、溶媒分子が固体分子をより効果的にバラバラにすることができるためです。
4。圧力:
*圧力は、液体の固体の溶解度に無視できる影響を及ぼします。
液体に可溶な固体の例:
* 水中の塩(NaCl): 極性溶媒に溶解するイオン化合物の一般的な例。
* 水中の砂糖(C12H22O11): 極性溶媒に溶解するイオン化合物の別の例。
* 水中のエタノール(C2H5OH): 極性溶媒に溶解する極性分子。
* ヘキサンのヨウ素(i2): 非極性溶媒に溶解する非極性分子。
重要なメモ:
* 溶解度の制限: 特定の温度で特定の液体にどれだけの固体を溶解できるかには、制限があります。これは溶解度制限と呼ばれます。
* 飽和: 溶液が溶解度の制限に達すると、飽和と言われます。さらに固体を追加しても溶解せず、底部の沈殿物として残ります。
* 溶解度に影響する要因: 温度、圧力、他の溶質の存在などのいくつかの要因は、液体の固体の溶解度に影響を与える可能性があります。
これらは単なる一般的なガイドラインであり、これらのルールには例外があることを忘れないでください。特定の液体での特定の固体の特定の溶解度は、実験的に決定できます。