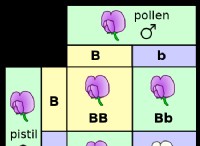
1。プレイヤー:
* 金属: 金属は、いくつかの価電子(最も外側のシェルに電子)を持つことによって特徴付けられます。それらは、安定した電子構成を実現するためにこれらの電子を *失う *傾向があります(貴重なガスのように)。
* 非金属: 非金属には、電子のほぼ完全な外殻があります。それらは、安定した構成を実現するために電子を *獲得する傾向があります。
2。交換:
* 電子移動: 金属原子は、その原子価電子の1つ以上を非金属原子に伝達します。
* イオン形成: 電子を失った金属原子は、正に帯電したイオン(陽イオン)になります。電子を獲得した非金属原子は、負に帯電したイオン(アニオン)になります。
3。アトラクション:
* 静電力: 陽イオンと陰イオンの反対の電荷は互いに強く惹かれます。これは、結晶格子にイオンを一緒に保持する静電力です。
4。クリスタル格子:
* 通常のアレンジメント: イオンは、結晶格子と呼ばれる高度に秩序化された3次元構造に自分自身を配置します。 特定の配置は、イオンのサイズと電荷に依存します。
* 強い債券: イオン間の静電力は強く、融点が高く沸点が高い化合物につながります。
例:塩化ナトリウム(NaCl)の形成
1。金属であるナトリウム(Na)には、1つの価電子があります。
2。非金属である塩素(Cl)は、外側のシェルを完成させるために1つの電子を必要とします。
3。ナトリウムはその原子価電子を塩素に伝達します。
4。ナトリウムは正の帯電イオン(Na+)になり、塩素は負に帯電したイオン(Cl-)になります。
5. Na+およびCl-イオンは互いに強く引き付けられ、結晶格子構造が形成されます。
キーポイント:
*イオン化合物は、反対に帯電したイオン間の静電引力によって形成されます。
*イオン化合物の形成には、共有されない電子の伝達が含まれます。
*得られた化合物は、通常、室温で固体です。
*イオン化合物は一般に、水のような極性溶媒に溶けます。
イオン化合物の形成の特定の側面のより多くの例や、より深い説明が欲しいかどうかを教えてください!