主な違い - 重水素と水素
水素は、原子番号 1 を持つ周期表の最初の元素です。これは、水素の原子核に陽子が 1 つあることを意味します。重水素は水素の安定同位体です。同位体は、陽子の数が同じで中性子の数が異なる同じ元素の原子であるため、水素と重水素の両方は、各核ごとに1つの陽子で構成されています。重水素と水素の主な違いは、重水素原子は原子核に中性子を含むのに対し、水素原子は原子核に中性子を含まないことです。 .
対象となる主な分野
1.水素とは
– 定義、プロパティ、アプリケーション
2.重水素とは
– 定義、プロパティ、アプリケーション
3.重水素と水素の類似点は何ですか
– 共通機能の概要
4 . 重水素と水素の違いは何ですか
– 主な違いの比較
重要な用語:原子質量、原子番号、重水素、重水素、水素、同位体、中性子、陽子 
水素とは
水素は、原子番号 1 の化学元素です。元素周期表の最初の元素です。それは、核内の単一の陽子で構成されています。水素の標準原子質量は 1.00794 u です。水素は地球上に存在する最も軽い元素です。水素原子は 1 として表すことができます
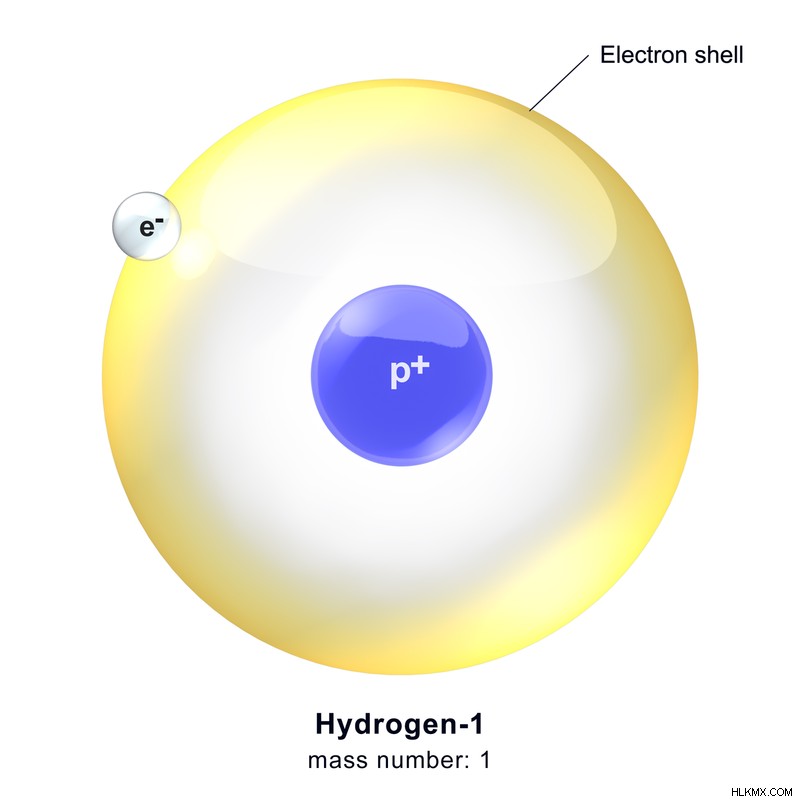
図 1:水素の化学構造 .
水素元素には 3 つの主要な同位体があります。それらは、プロチウム、重水素、およびトリチウムです。プロチウムは、これら 3 つの同位体の中で最も豊富な形態です。その存在量は約99%です。したがって、通常の水素と見なされます。プロチウム原子は陽子で構成されており、中性子はありません。結合していないときは、電子が 1 つ観測されます。水素の電子配置は1sです。 s 軌道は 1 つだけで、p 軌道はありません。
水素は、H2 として最も一般的に見られます。 気体または水などの液体 (H2 O)。水素がH2にある場合 気体であり、可燃性が高く、燃焼する可能性があります。したがって、化石燃料の処理に使用されます。水素は、アンモニアの生産における主要な反応物としても使用されます。水素のもう 1 つの重要な用途は、発電所の発電機の冷却剤としての使用です。
重水素とは
重水素は水素元素の安定同位体です。陽子1個と中性子1個を持つ原子核を含んでいます。原子核の外では、重水素は 1 つの電子を持っています。重水素の原子番号は 1 です。重水素の原子質量は約 2.014 u です。重水素は H.
のように記号で表すことができます。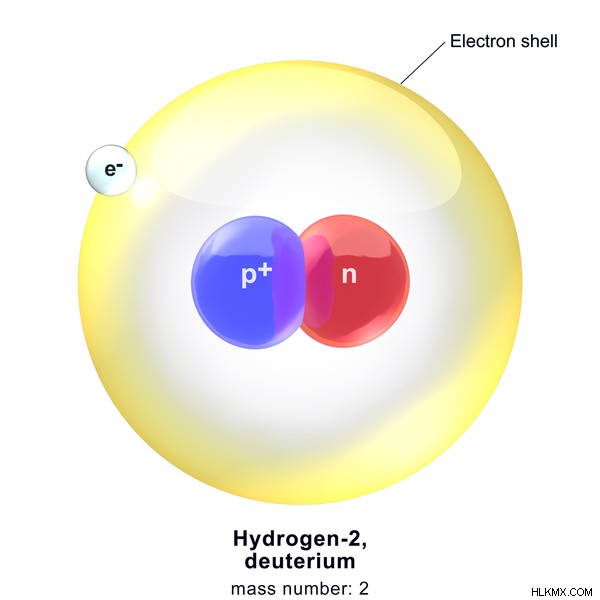
図 2:重水素の化学構造
地球の地殻における重水素の存在量は約 0.015% です。重水素は安定なので、放射性元素ではありません。通常の水素よりも重いため、重水素とも呼ばれます。純粋な重水素ガスはめったに見つかりません。ほとんどの場合、D2 ではなく HD (H-D) ガスが見つかります。
重水は、D2 から作られた水の形です H2 の代わりに O 分子 O分子。 D2 から重水と呼ばれる O は H2 より重い O. D2 のモル質量 O は約 20 g/mol であるのに対し、H2 のモル質量は O は 18 g/mol です。重水は、有機化学の合成反応で重水素源として使用されます。
重水素の原子核は重陽子と呼ばれます .この原子核の質量は約 2.013 u です。重水素は奇数の陽子と奇数の中性子で安定です。奇数の陽子または中性子を持つほとんどの原子核は不安定であり、この不安定性のためにベータ崩壊を受けます.
重水素は核分裂炉で重水の形で使用されます。ここでは、中性子を減速するために使用されます。重水素は CDCl3 として陽子 NMR 分光法でも使用されます。 軽水素のスペクトルを溶媒中の水素と区別するため。
重水素と水素の類似点
- 水素も重水素も、1 つの陽子と 1 つの電子で構成されています。
- 両方の原子番号は 1 です。
- どちらのタイプの原子も s 軌道しか持っていません。
- どちらの原子も水の形で見つかります。
重水素と水素の違い
定義
重水素: 重水素は水素元素の安定同位体です。
水素: 水素は原子番号 1 の化学元素です。
原子量
重水素: 重水素の原子質量は 2.014 u です。
水素: 水素の原子質量は 1.00794 u です。
元素記号
重水素: 重水素は、D または 1 のいずれかで表すことができます
水素: 水素は、H または 1 のいずれかで表すことができます
自然の豊かさ
重水素: 重水素の存在量は約 0.015% です。
水素: 水素の存在量は約 99% です。
まとめ
重水素は水素の同位体です。プロチウムは水素の最も豊富な同位体であるため、通常の水素と見なされます。 Protium の存在量は約 99% です。ただし、同位体であることに加えて、重水素と水素には明確な違いがあります。







