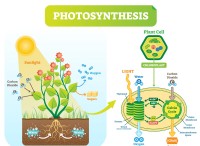
その理由は次のとおりです。
* 酸 陽子(H⁺)を水分子に寄付し、水素イオンの濃度を増加させます。このプロセスは、次の方程式で表されます。
`` `
ha +h₂o
`` `
ここで、haは酸であり、a⁻はその共役ベースです。
* ベース 水分子からプロトン(H⁺)を受け入れ、水素イオンの濃度を減らし、水酸化物イオン(OH⁻)の濃度を増加させます。このプロセスは、次の方程式で表されます。
`` `
B +H₂O
`` `
ここで、bは塩基であり、bh⁺はその共役酸です。
要約:
* 酸 oh⁻よりもh₃o⁺の濃度が高い。
* ベース h₃o⁺よりも濃度が高い。
pHスケールはこの関係を反映しています。
* 低pH値 より高い濃度のh₃o⁺(酸性)を示します。
* 高いpH値 H₃O⁺(基本)の濃度が低いことを示します。