1。電子構成:
*硫黄-36には16個のプロトンと16個の電子があります。その電子構成は2-8-6です。これは、最も外側のシェル(価電子)に6つの電子があることを意味します。
2。オクテットルール:
*原子は、貴族のような安定した電子構成を達成するよう努めています。オクテットの規則では、原子は安定性のために最も外側のシェルに8つの電子が必要であると述べています。
3。電子の獲得:
*硫黄は、完全なオクテット(その原子価シェルに8電子)を実現するために、さらに2つの電子を獲得する必要があります。
4。イオン形成:
*硫黄が2つの電子を獲得すると、負に帯電します。各電子には-1電荷があるため、2つの電子を獲得すると-2電荷が発生します。
5。硫化物イオン:
* -2電荷を含む結果のイオンは硫化物イオンと呼ばれ、s 2- として表されます 。
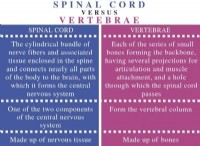
概要:
硫黄-36の原子は硫化物イオンになります(S 2 - )2つの電子を獲得することにより。これは、最も外側のシェルに完全なオクテットを備えた安定した電子構成を実現したいという原子の欲求によって駆動されます。