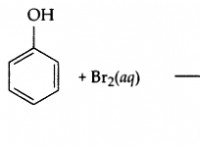
* 強力な静電力: イオン格子内の反対に帯電したイオン間の強い静電引力は、イオンをしっかりと詰めます。この密接な梱包は、構造内にほとんど空のスペースを残します。
* 高いイオン電荷: イオン電荷が高いと静電魅力が強くなり、化合物の密度がさらに向上します。
* 小さなイオン半径: より小さなイオンはより効率的に梱包することができ、より高い密度になります。
より詳細な説明を次に示します。
1。強力な静電力: イオン結合は、正に帯電した陽イオンと負に帯電した陰イオンとの間の静電引力によって形成されます。この魅力は非常に強く、イオンを互いに引き寄せ、しっかりと詰め込まれたクリスタル格子を形成します。
2。高イオン電荷: 静電引力の大きさは、イオンの電荷に直接比例します。より高い電荷はより強いアトラクションにつながり、その結果、よりコンパクトな格子が生じ、したがって密度が高くなります。
3。小さなイオン半径: イオンのサイズも密度に影響します。より小さなイオンは、より効率的に格子に詰まり、密度が高くなります。これは、より小さなイオンの体積が少ないため、より近く合うことができるためです。
例:
塩化ナトリウム(NaCl)は、高密度のイオン化合物の一般的な例です。ナトリウムイオン(Na +)は比較的小さく、+1電荷を持っていますが、塩化物イオン(CL-)は大きいですが、-1電荷があります。これらのイオン間の強い静電引力は、しっかりと詰め込まれた立方格子を引き起こし、2.16 g/cm³の密度をもたらします。
結論:
強力な静電力、高イオン電荷、および小さなイオン半径の組み合わせは、イオン化合物の高密度に寄与します。これらの化合物は、空のスペースがほとんどない、しっかりと詰められた結晶格子によって特徴付けられ、単位体積あたりの質量が高くなります。