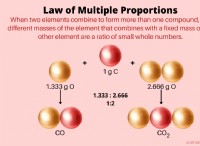
1。 「ように溶ける」という理解
「Like溶解のような」の原則は、溶解度の基本的な概念です。同様の化学的特性を持つ物質は、互いに溶解する傾向があると述べています。 これは、分子間力の相互作用によるものです。
* 極分子: 水(H₂O)は非常に極性分子です。つまり、電子の不均一な共有のために正と負の終わりがあります。他の極性分子と強い水素結合を形成します。
* 非極性分子: 二炭素ジスルフィド(CS₂)は非極性分子であり、電子が均等に共有されており、有意な電荷分離はありません。それは主に弱いロンドン分散勢力を通して相互作用します。
2。硫黄の性質
硫黄は非極要素です。それは、硫黄原子がリングまたはチェーンの配置で結合する構造を持つ固体として存在します。この配置は強い極性相互作用につながりません。
3。硫黄がジスルフィド炭素に溶解する理由
* 同様の力: 硫黄とジスルフィドの両方の両方が非極性です。それらは主に、硫黄原子間の誘引を克服し、炭素ジスルフィドに溶解できるようにするのに十分な弱いロンドン分散力を介して相互作用します。
4。硫黄が水に溶けない理由
* 互換性のない力: 非極性である硫黄は、極水分子と強く相互作用しません。水中の強い水素結合は、硫黄と水分子の間のロンドン分散勢力よりもはるかに強いです。これにより、硫黄が独自の構造から解放され、水に溶けることが非常に困難になります。
要約: 硫黄の溶解度は、同様の分子間力を介して溶媒と相互作用する能力に依存します。硫黄のような非極性であるジスルフィドは、溶解に必要な相互作用を提供しますが、強い極性では水はそうではありません。