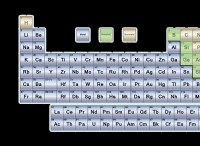
電気陰性度の理解
*電気陰性度は、化学結合で電子を自分自身に引き付ける原子の能力の尺度です。
*電気陰性度が高い元素は、電子をより強く引っ張っています。
結合タイプの識別
1。大きな電気陰性度の違い: 2つの結合原子間の電気陰性度の違いが大きい場合 (通常、1.7を超える)、電子はより電気陰性の原子に強く引っ張られます。これにより、充電に大きな違いが生じ、イオン結合につながります 。イオン結合では、1つの原子が本質的に電子をもう一方の原子に「寄付」し、互いに引き付ける反対の電荷でイオンを形成します。
2。小さな電気陰性度の違い: 電気陰性度の差が小さい場合 (通常1.7未満)、電子は2つの原子間でより均等に共有されます。これにより、共有結合が生じます 。 共有結合では、共有電子はより多くの電気陰性原子に近い時間を費やし、わずかに極性の結合を生み出します。
例
* naCl(塩化ナトリウム): ナトリウム(Na)の電気陰性度は0.93、塩素(Cl)の電気陰性度は3.16です。大きな違い(2.23)はイオン結合につながり、ナトリウムは電子を失い、Na+になり、塩素は電子を獲得してCl-になります。
* H2O(水): 酸素(O)の電気陰性度は3.44、水素(H)の電気陰性度は2.20です。より小さな差(1.24)は共有結合をもたらし、そこでは電子が原子間で共有されますが、酸素原子の近くでより多くの時間を費やして結合をわずかに極性にします。
覚えておくべきキーポイント
*電気陰性度は有用なガイドラインですが、厳格なルールではありません。
*差が1.7に近い中間ケースがあります。これらの結合は、イオン結合と共有結合の両方の特性を示す可能性があります。
*結合の性質は、原子のサイズや関連する軌道の種類などの要因の影響を受ける可能性があります。
結論として、2つの結合原子間の電気陰性度の違いは、結合が主にイオン性または共有結合であるかどうかを決定する上で重要な要因です。