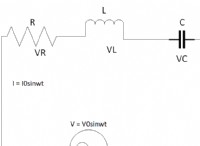
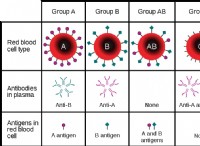
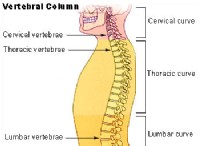
これは、電気陰性の差と結合タイプの間の接続の内訳です。
* 電気陰性度: 結合内で電子を引き付ける原子の能力の尺度。
* 電気陰性の差: 2つの結合原子間の電気陰性度の差の絶対値。
経験則:
* 差<0.5: 結合は非極性共有結合と見なされます 。 電子はかなり均等に共有されます。
* 0.5と1.7:の差 結合は極性共有結合と見なされます 。 電子は不均等に共有され、より多くの電気陰性原子がわずかに負の電荷を持っています。
* 差> 1.7: 結合はイオンと見なされます 。 電子は、より少ない電気陰性原子からより多くの電気陰性原子に完全に伝達され、イオンの形成をもたらします。
重要なメモ:
*このルールは単純化です。例外があります! 1.7と2.0の違いのある一部の結合は、極性共有結合と見なされる場合があります。
*結合のタイプは、原子のサイズや関与する電子の数などの要因の影響を受けます。
*結合タイプを決定するときに、電気陰性度テーブルを参照することをお勧めします。
さまざまな電気陰性の違いを持つ結合の例が欲しいかどうか教えてください!