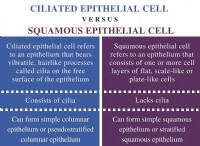
* hcl 強酸であり、溶液中に完全にイオン化してH+イオンとcl-イオンを形成します。
* naoh 強いベースであり、それは溶液で完全にイオン化して、Na+イオンとオハイオンを形成します。
反応:
H +(aq) + cl-(aq) + na +(aq) + oh-(aq)→h2o(l) + na +(aq) + cl-(aq)
説明:
* 水素イオン(H+) 酸から水酸化物イオン(OH-)と反応します ベースから水(H2O)を形成します 。これが中和反応の中核です。
* ナトリウムイオン(Na+) および塩化物イオン(Cl-) 観客イオンとして溶液を維持します。つまり、反応に直接関与しないことを意味します。
結果:
この反応は、テーブル塩としても知られる塩化ナトリウム(NaCl)の中性溶液を生成します。 等量の等量の等量のモル濃度溶液が使用されるため、溶液は正確に中立で、pHは7です。