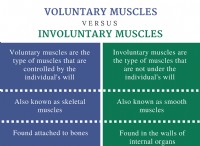
1。分子構造:
* 水: 中心酸素原子に結合した2つの水素原子を持つ曲がった分子形状を持っています。酸素原子には2つの孤立した電子ペアがあり、これにより双極子モーメントが生成され、水が極性分子になります。
* 過酸化水素: 2つの酸素原子が互いに結合し、1つの水素原子が各酸素に付着した非線形構造を持っています。この配置は、水と比較して、水素結合が弱く、極性の低い性質につながります。
2。結合:
* 水: 酸素の電気陰性度が高いことと孤立ペアの存在により、強い水素結合を形成します。これらの結合は、その高い沸点や表面張力など、水のユニークな特性の多くを担当しています。
* 過酸化水素: また、水素結合も形成されますが、分子の極性の性質が低いため、水中の結合よりも弱いです。この弱い結合は、過酸化水素の低い沸点と不安定性の向上に寄与します。
3。化学的特性:
* 水: 比較的安定した化合物であり、しばしば溶媒と反応物として作用します。 pHが7の中性分子です。
* 過酸化水素: 強力な酸化剤であり、非常に反応性があります。それは約4.5のpHで弱酸です。多くの場合、熱が放出されると、水と酸素ガスに容易に分解されます。このプロパティは、消毒剤と漂白剤として有用です。
4。物理的特性:
* 水: 水素結合が強いため、過酸化水素(-89°C)よりも高い沸点(100°C)があります。過酸化水素よりも密度が高いため、単位体積あたりの質量が高いことを意味します。
* 過酸化水素: 室温の無色の粘性液体です。それは強力な漂白剤であり、水と酸素ガスに分解することができます。
要約すると、水と過酸化水素の重要な違いは、その分子構造と結合にあります。水の強い水素結合は、安定性が高く、沸点が高く、極性の性質が高くなりますが、過酸化水素の弱い結合は、反応性が高く、沸点が低く、極性が低くなります。これらの違いは、それらの異なる化学的および物理的特性に貢献します。