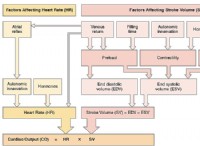
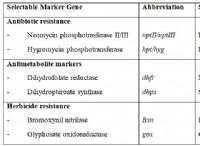
これが故障です:
滴定 は、既知の濃度(滴定)の溶液と反応することにより、未知の溶液(分析物)の濃度を決定するために使用される定量的化学分析技術です。
これがどのように機能するかです:
1。準備: 既知の容量の分析物溶液と、既知の濃度の滴定溶液で満たされたビュレットから始めます。
2。滴定: 滴定剤は、それらの間の反応がエンドポイントに到達するまで、分析物溶液にゆっくりと追加されます。 エンドポイントは通常、色の変化または沈殿物の形成によって示されます。
3。分析: エンドポイントに到達するために使用される滴定剤の体積が測定されます。この体積は、抑制性の既知の濃度とともに、化学量論を使用して分析物の濃度を計算することができます。
重要な用語:
* 分析物: 濃度が不明なソリューション。
* 滴定: 既知の濃度の溶液。
* エンドポイント: 分析対象物と滴定の反応が完了するポイント。
* 等価ポイント: 分析対象物と滴定のほくろが等しい理論的な点。
滴定の種類:
* 酸ベース滴定: 滴定剤として強酸または塩基を使用して、未知の酸または塩基の濃度を決定します。
* 酸化還元滴定: 酸化または還元剤を滴定剤として使用して、未知の酸化または還元剤の濃度を決定します。
* 降水滴定: 分析物と沈殿物を形成する試薬を使用して、その濃度を決定します。
* 複合体滴定: 複合剤を滴定剤として使用して、金属イオンの濃度を決定します。
例:
未知の塩酸(HCl)溶液の濃度を決定したいと想像してください。水酸化ナトリウム(NAOH)の既知の溶液を滴定液として使用できます。 HCL溶液にNaOHを追加すると、反応は塩と水を生成します。インジケータが存在するため、溶液がわずかにピンクになったときにエンドポイントに到達します。 使用したNaOHの体積とその既知の濃度により、元のHCl溶液の濃度を計算できます。
滴定について他に質問がある場合はお知らせください!