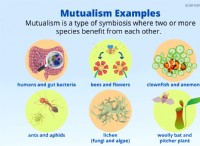
イオン結合:
* 電子移動: アルミニウム(AL)には3つの価電子があり、塩素(Cl)には7つの原子価があります。アルミニウムは、安定したオクテットを達成するために3つの原子価電子を失い、+3カチオン(al³⁺)になります。塩素は容易に1つの電子を獲得して安定したオクテットを達成し、-1アニオン(cl⁻)になります。
* 静電引力: 結果として得られる反対に帯電したイオン(al³⁺とcl⁻)は、強い静電力によって結合され、イオン結合を形成します。
共有キャラクター:
* 極性: アルミニウムと塩素の電気陰性の違いは、典型的なイオン結合ほど大きくありません。これにより、電子が均等に共有されない極性共有結合が作成されます。
* 気相中の塩化アルミニウム: 気相では、Alcl₃は共有結合を持つ離散分子として存在します。これは、al³⁺イオンが小さく、非常に偏光があり、clotionの電子雲を引き付けるためです。
結論:
* 固体状態: その固体状態では、塩化アルミニウムは、層の間にイオン結合と層内の共有結合を伴う層状構造として存在します。
* 液体と気体状態: 液体および気体状態では、Alcl₃は、高度に分極しているAl³⁺イオンの影響により、より共有特性を示します。
したがって、Alcl₃は混合イオン共有結合特性を持っていると最もよく説明されています。 それは純粋にイオン性ではありませんが、al³⁺イオンとcl⁻イオンの間の強い静電相互作用は、その結合の重要な部分です。