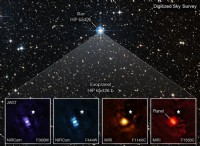
その理由は次のとおりです。
* 水素結合 高強性原子(酸素、窒素、またはフッ素など)に共有結合した水素原子と、隣接する電気陰性原子の孤立ペアの電子ペアとの間の形態。
* メタン 、炭素原子は非常に電気陰性ではありません。それは水素原子と等しく電子を共有し、非極性共有結合をもたらします。
* 電気陰性度に有意な差はありません 炭素と水素の間には、水素原子に部分的な正電荷がないため、水素結合を形成します。
要約: 水素結合は、電気陰性度の違いを持つ原子の特定の配置を必要とする特別な種類の分子間相互作用です。メタンはこれらの基準を満たしていないため、水素結合を示しません。