多くの異なる官能基の中で、アミドは単結合によって窒素、水素、またはその両方に結合したカルボニル基です。アミンとアンモニアは窒素含有化合物であり、アミドはアンモニアのカテゴリに分類されます。酸のヒドロキシル基 (OH) をアミノ基に変更すると、酸性でも中性でもない分子が得られます (NR2、水素原子またはメチル CH3 などの有機結合基のいずれかを表す場合があります)。カルボン酸 (R'COOH) に由来するカルボキサミド (R'CONR2) は、最も重要なクラスです。構造がスルホン酸と同様に、RSO2NR2 スルホンアミドが見られます (RSO3H)。アンモニア、アミン、または共有結合アミドは、ナトリウムなどの反応性金属と結合してイオン性アミド (強アルカリ性化学物質) を形成します。 CO-NH は、アミド基式またはアミド式です。
共有アミド
ホルムアミドを除いて、すべての共有結合アンモニア生成アミドは固体です。炭素数が 5 未満のものは水溶性です。無機および有機溶媒は電気の不導体です。共有結合アミドの沸点は、分子量が小さいものであっても比較的高いです。
生物系のタンパク質として、ポリアミド (ポリマーと呼ばれる大きな分子を作るために結合したアミド) が豊富にありますが、単純な共有結合アミドの天然源にはありません。アンモニアまたはアミンは、酸または酸ハロゲン化物と反応して単純なアミドを生成するためによく使用されます。ニトリルと水も反応してそれらを形成する可能性があります。
酵素、強酸、またはアルカリが存在しない限り、加水分解 (水との化学反応) は、共有結合アミドが酸とアミンに変換されるプロセスです。アミドの脱水により、ニトリルが得られる場合があります。ただし、高温高圧での水素の添加 (水素化とも呼ばれる) は、触媒が存在する場合、ほとんどのカルボン酸アミドをアミンに変換する可能性があります。
強力な還元剤である水素化アルミニウム リチウムは、アミドをアミンに変換します。アミドが酸塩化物または酸無水物と反応すると、2 つのカルボニル (CO) 基が同じ窒素原子に結合します。
いくつかの主要な商用アミドには、エタンアミド (CH3CONH2)、溶媒、ジメチルホルムアミド HCON(CH3)2、サルファ剤、ナイロンなどがあります。これは、タンパク質合成の副産物として形成され、動物の尿中に排泄される結晶分子です。尿素は、カルバミド [CO(NH2)2] としても知られています。プラスチックの作成に使用される尿素ホルムアルデヒド樹脂を合成するには、大量のアンモニアと二酸化炭素が必要です。
アミドの命名法
アミドとは何か、またそれがどのように言及されているかを調べてみましょう。標準的な命名法では、親酸の名前の最後の音節の前に接尾辞「アミド」が追加されます。酢酸はアミドアセトアミドを生成します。 CH3CONH2 はアミド構造の例です。 International Union of Pure and Applied Chemistry (IUPAC) はエタナミドの標準用語を推奨していますが、これや他の正式な名前はめったに使用されません。第一級または第二級アミンに由来するアミドの名前では、窒素置換基が最初に現れます。
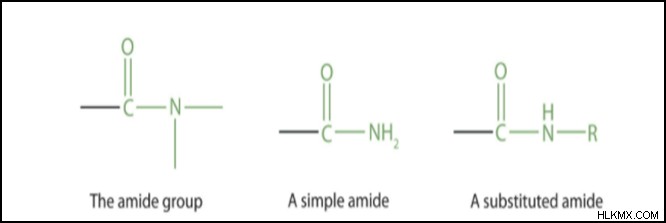
CO-NH は酸アミド式ですか、それともアミド式ですか?
ジメチルアミンを酢酸と反応させて生成したアミド構造は、N, N-ジメチルアセトアミド (CH3CONMe2,) を生成します。ジメチルアセトアミドという用語全体でさえ、しばしば省略されます。ラクタムは、第二級または第三級に分類される環状アミドです。
アミドの製造
窒素原子がアミドの炭素原子に結合し、アミドになります。アミンと同様に、アミドにもさまざまな命名要件がありますが、すべてクラス固有の接尾辞 – アミドが付いています。
カルボン酸は、アミド化プロセス中にアミンまたはアンモニアと結合してアミドを形成します。プロセスから水分子が除去されると、カルボン酸とアミンの残りの部分からアミドが生成されます。
アミンとカルボン酸からのアミドの合成は、本質的に生物学的なプロセスです。アミノ酸(カルボン酸がアミンに置換された分子鎖)の重合により、タンパク質が合成されます。
アミドのカテゴリー
アミドを調べる前に、名前であろうと構造であろうと、語彙の基本を理解する必要があります。アミンは、その命名法に従って、1 級アミン、2 級アミン、3 級アミンの 3 つのカテゴリに分類されます。違いは、分子鎖の炭素原子に対する窒素原子の位置に従って分類されます。第一級アミドは、接尾辞「アミド」をそれぞれ「ic酸」または「oic酸」の末尾に追加することで識別できます。
「二級アミド」という用語には、窒素がアルキル基に結合していることを示す N が組み込まれています。アルキル基は、水素原子と炭素原子を含む炭化水素鎖です。
官能基アミド
識別と認識は、より巨大な分子のアミド官能基を使用することによって実現されます。官能基の例は、アルカン、アルコール、およびアミドです。カルボン酸活性基は、カルボニル基と窒素原子を持つ官能基であるアミドを生成する場合があります。
アミド分子骨格
アミド構造を理解するには、アミド分子が窒素原子を持っている必要があることを知ることが重要です。カルボニル基では、酸素原子に結合した 2 つの炭素原子が 2 つの二重結合を形成します。別のアミン基は、単一の窒素原子が R 基と結合しているものです。 R基は、構造中の置換基と考えることができます。最後に、単結合だけがアミドを区別する官能基としても機能します。
塩基性
一方、アミドは弱塩基です。アミンの共役酸の pKa が約 9.5 であるのに対し、アミドの共役酸の pKa は約 0.5 です。結果として、水中では、アミドは明確な酸塩基挙動を示しません。塩基性がないのは、カルボニルがアミンから電子を除去するためです。アミドの共役酸の pKa は 6 から 10 まで変化し、カルボン酸、エステル、アルデヒド、およびケトンよりもはるかに強力な塩基になります。
結論
多くの異なる官能基の中で、アミドは単結合によって窒素、水素、またはその両方に結合したカルボニル基です。基またはアミド式はCO-NHです。
アミド分子には窒素原子が必要です。アミンは、その命名法に従って、1 級アミン、2 級アミン、3 級アミンの 3 つのカテゴリに分類されます。違いは、分子鎖の炭素原子に対する窒素原子の位置に従って分類されます。第一級アミドは、接尾辞「アミド」をそれぞれ「ic酸」または「oic酸」の末尾に追加することで識別できます。







