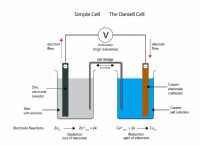
* 原子はニュートラルです: 原子には通常、バランスの取れた数のプロトン(積極的に帯電)と電子(負に帯電しています)があります。これにより、それらは電気的にニュートラルになります。
* 電子親和性: 一部の原子は、他の原子よりも電子の魅力が大きいです。この魅力は電子親和性と呼ばれます。
* 電子の獲得: 電子親和性が高い原子が電子に遭遇すると、電子の総数を追加して、「つかむ」ことができます。
* 正味負電荷: 原子にはプロトンよりも多くの電子があるため、負に帯電します。これがそれを陰イオンにするものです。
例:
*塩素原子(CL)には17個のプロトンと17個の電子があり、中性になります。
*塩素は電子親和性が高い。
*塩素が電子を獲得すると、塩化物イオン(Cl-)になり、17個のプロトンと18個の電子があるため、-1の正味負電荷が得られます。
キーポイント:
* 電子親和性: 電子親和性が強いほど、原子が負のイオンを形成する可能性が高くなります。
* 安定性: アニオンは、多くの場合、中性の対応物よりも安定しています。これは、彼らが貴族と同様に、より安定した電子構成を達成するためです。
* 化学結合: 陰イオンはしばしば、カチオン(正に帯電したイオン)とイオン結合を形成して、中性化合物を作ります。
他に質問がある場合はお知らせください。