主な違い - ヘリウムと水素
水素とヘリウムは、元素の周期表で最初に見つかった 2 つの元素です。したがって、それらは地球上で最も小さくて軽い原子です。どちらもガス状の物質です。水素とヘリウムの特徴により、これらのガスは産業界で多くの用途があります。これらのガスは非常に軽量であるため、気球に充填するために使用されます。ヘリウムと水素の主な違いは、ヘリウム原子は大気中に単原子ガスとして存在するのに対し、水素は大気中に二原子ガスとして存在することです。
対象となる主な分野
1. ヘリウムとは
– プロパティ、同位体、反応、およびアプリケーション
2.水素とは
– プロパティ、同位体、反応、およびアプリケーション
3.ヘリウムと水素の類似点は何ですか
– 共通機能の概要
4.ヘリウムと水素の違いは何ですか
– 主な相違点の比較
重要な用語:原子量、原子番号、重水素、ヘリウム、水素、ヘリウムの同位体、プロチウム、トリチウム 
ヘリウムとは
ヘリウムは原子番号 2 の元素で、気体です。ヘリウムの化学記号は He です。ヘリウムの電子配置は 1s です。ヘリウムの原子記号は 2 です 彼。ヘリウムの原子は、原子核内の 2 つの陽子と 2 つの中性子と、その 1s 軌道内の 2 つの電子で構成されています。したがって、ヘリウムの原子質量は 4.002602 amu です。室温と圧力では、ヘリウムは無色無臭の気体です。ヘリウムは、宇宙で 2 番目に豊富な元素と考えられています。単原子気体として存在します。
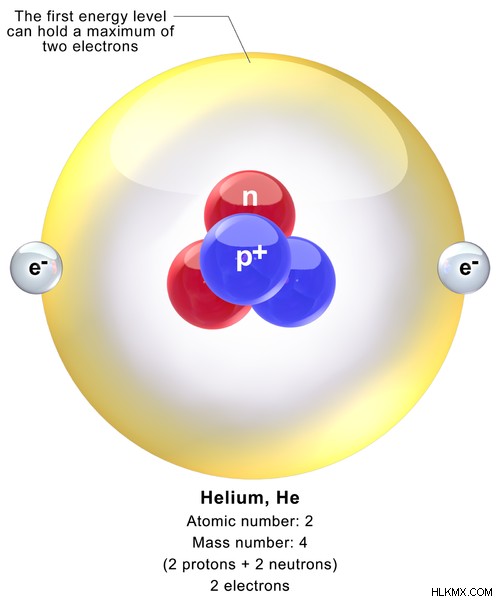
図 1:ヘリウム原子の化学構造
ヘリウムの融点は約-272.2℃で、非常に低い値です。ヘリウムの沸点は-268℃です。これにより、より広い温度範囲で使用できるガスになります。元素の周期表では、ヘリウムは s ブロック元素に分類されますが、表の右側の隅に配置されます。これは、ヘリウムが化学反応を起こさない不活性ガスであるためです。非金属でもあります。
ヘリウムは希ガスなので、酸化状態はゼロです。ヘリウムには 2 つの同位体が知られています。 He同位体とHe同位体です。彼はその中で最も豊富な形態であり、その豊富さは 99% とされています。これらの同位体は両方とも安定しており、放射性崩壊は観察されません。ただし、他の同位体もいくつかあります。それらは不安定で放射性があります。
ヘリウムは気球で広く使用されています。さらに、ヘリウムはその不活性度が高いため、多くの合成反応 (シリコン結晶の合成など) に制御された雰囲気を提供するために使用されます。また、アーク溶接の不活性シールドとしても使用されます。ヘリウムは、液体ヘリウムとして知られる液体の形に変換でき、重要な極低温材料として使用されます。
水素とは
水素は原子番号 1 の化学元素で、記号 H で表されます。水素の原子は、核内に 1 つの陽子で構成され、中性子はありません。 1s軌道に1個の電子があります。水素の電子配置は 1s として与えられます。水素は、周期表の s ブロック要素です。水素の原子量は 1.00794 amu です。
室温と圧力では、水素は二原子気体分子として存在します。無色無臭の気体です。水素の融点は約-259℃です。沸点は-252℃前後です。水素には 3 つの酸化状態があります。 -1、0、+1 です。水素が金属原子に結合すると、酸化状態が -1 になります。
水素の主要な同位体には、プロチウム、重水素、トリチウムの 3 つがあります。 プロティウム 最も豊富な同位体であり、99% の存在量を持っています。したがって、一般的に水素について話すときは、Protium について話していることになります。 重水素 も安定同位体ですが、量は少ないです。核内に中性子を持っていますが、プロチウムにはありません。 トリチウム 放射性同位体です。さらに、安定しておらず、放射性が高い同位体は他にもたくさんあります。
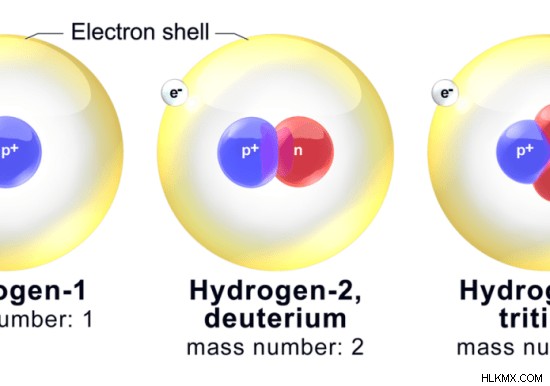
図 2:水素の主要な同位体
水素ガスには多くの用途があります。化石燃料の処理には大量の水素が使用されます。水素ガスは、アンモニアの製造にも使用されます。さらに、水素は発電所の冷却材としても使用されています。
ヘリウムと水素の類似点
- ヘリウムと水素は、標準の温度と圧力の状態では気体の物質です。
- どちらも 1s 軌道しかありません。
- どちらも小さくて軽い物質です。
- どちらの元素も周期表の s ブロックに属しています。
- どちらも非金属です。
ヘリウムと水素の違い
定義
ヘリウム: ヘリウムは原子番号 2 の元素で、記号 He で表されます。
水素: 水素は原子番号 1 の化学元素で、記号 H で表されます。
原子番号
ヘリウム: ヘリウムの原子番号は 2 です。
水素: 水素の原子番号は 1 です。
原子量
ヘリウム: ヘリウムの原子量は 4.002602 amu です。
水素: 水素の原子量は 1.00794 amu です。
化合物
ヘリウム: ヘリウムは単原子気体物質として存在します。
水素: 水素は二原子気体分子として存在します。
酸化状態
ヘリウム: ヘリウムは酸化状態が 0 しかありません。
水素: 水素には、-1、0、および +1 の酸化状態があります。
同位体
ヘリウム: ヘリウムには、He と He という 2 つの主要な同位体があります。
水素: 水素には 3 つの主要な同位体があります。プロチウム、重水素、トリチウム。
融点
ヘリウム: ヘリウムの融点は-272.2℃です。
水素: 水素の融点は-259℃です。
結論
ヘリウムと水素は、融点と沸点が非常に低いため、ほとんどがガス状物質として大気中に存在する化学元素です。ヘリウムと水素の主な違いは、ヘリウム原子が大気中に単原子ガスとして存在するのに対し、水素は大気中に二原子ガスとして存在することです.







