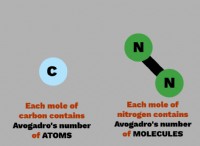
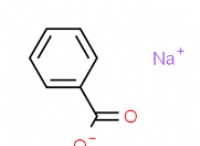
* イオン結合: alcl 3 伝統的にイオン化合物と考えられており、アルミニウムと塩素の電気陰性の違いは、完全にイオン結合に十分な大きさではありません。
* 極性共有結合: Alcl 3 の結合 より正確には極性共有結合として説明されています。これは、アルミニウム原子と塩素原子の間に電子が大幅に共有され、イオン間の静電引力が弱くなることを意味します。
* ダイマー形成: 固体状態では、Alcl 3 二量体として存在します(al 2 cl 6 )。この二量体形成には、2つのアルミニウム原子間で塩素原子の共有が含まれ、イオン性の特性をさらに低下させ、全体的な構造を弱めます。
* 分子間力の弱い: Alcl 3 の二量体構造 分子間の弱いファンデルワールスの力につながり、融解中に克服するエネルギーが少なくなります。
alcl 3 とは対照的です 、NaClのような他のイオン化合物は、イオンの間に強い静電引力を持ち、より高い融点をもたらします。
これらのポイントのいずれかの詳細をご希望の場合はお知らせください!