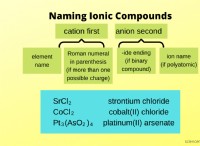
ほとんどのガスが一般にKMTに従う理由は次のとおりです。
* KMTの仮定: KMTは、ガス分子は無視できる容積を持つポイント質量であり、弾性衝突によってのみ相互作用し、平均運動エネルギーは温度に比例していると想定しています。これらの仮定は、通常の条件下でほとんどのガスに当てはまります。
* 理想的なガス法: KMTは、標準温度と圧力での多くのガスの挙動を正確に説明する理想的なガス法の基礎を形成しています。
* 実際のガス: ほとんどのガスは通常の条件下で理想的に動作しますが、理想的な行動からの逸脱は、より高い圧力と低温でより重要になります。これは、これらの条件下でガス分子間の分子間の力がより重要になり、ガス分子自体の体積がより重要な要因になるためです。
要約、 運動分子理論は、特に理想的な条件下で、ほとんどのガスの挙動を理解するための優れたモデルを提供します。ただし、理論の限界を認識し、極端な条件下で発生する可能性のある理想的な行動からの逸脱を考慮することが重要です。