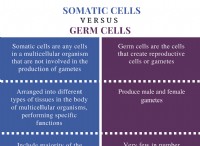
1。バランスの取れた化学式
まず、炭素(c)と二酸化硫黄(SO₂)の間の反応のためのバランスの取れた化学式が必要です。
C +2SO₂→CO₂ + 2S
2。モル比
バランスの取れた方程式は、1モルの炭素(c)が2モルの二酸化硫黄(SO₂)と反応することを示しています。
3。計算
0.540モルのSO₂があります。 必要なモルの炭素がいくつあるかを確認するには、割合を設定できます。
(1モルC) /(2モルSO₂)=(XモルC) /(0.540モルSO₂)
xの解決:
x =(1モルC * 0.540モルso₂) /(2モルSO₂)
x =0.270モルc
回答: 0.540モルのSO₂と反応するには、0.270モルの炭素が必要です。