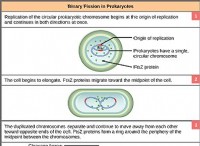
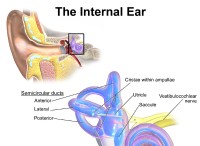
その理由は次のとおりです。
* 極性と水素結合: 水は極性溶媒です。つまり、電子の不均一な分布のために正と負の端があります。ベンゾ酸には、極性カルボン酸基(-COOH)もあります。ただし、ベンゾ酸分子の残りの部分は非極性ベンゼン環です。
* 溶解度: 物質が水に溶けるには、水素結合を介して水分子と好意的に相互作用する必要があります。ベンゾ酸中の極カルボン酸基は、水との水素結合に関与する可能性がありますが、非極性ベンゼン環はこの相互作用を妨げます。
* 限られた溶解度: ベンゾ酸の限られた溶解度は、非極性ベンゼン環の間のより強い魅力と、カルボン酸基と水分子の間の弱い魅力によるものです。
したがって、ベンゾ酸は室温で水に容易に溶けませんが、極性カルボン酸基の存在により、ある程度溶解します。