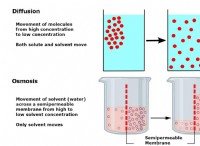
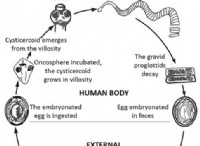
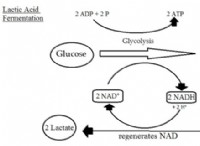
トレンド:
* グループ17(ハロゲン)を下ると沸点と融点が増加します。
説明:
この傾向は、ハロゲン分子間の分子間力の強度の増加によるものです。その理由は次のとおりです。
* van der Waals Force: ハロゲン分子間の主要な分子間力は、ロンドン分散力(一種のファンデルワールス力)です。これらの力は、分子内の電子の動きのために発生する一時的な変動する双極子から生じます。
* 偏光: グループを下に移動すると、ハロゲン原子が大きくなります。 これは、彼らがより多くの電子を持っていることを意味し、これらの電子は核から遠くにあります。これにより、電子雲がより簡単に歪んでしまいます(分極可能)。
* より強いロンドン分散部隊: 偏光が大きくなると、一時的な双極子が強くなり、その結果、ロンドンの分散力が強くなります。
* 必要なエネルギー: 分子間力が強くなると、より多くのエネルギーが克服する必要があります。これにより、より高い沸点と融点が生じます。
要約:
1。より大きな原子=より多くの電子=より多くの分極可能な電子雲。
2。より多くの分極可能な電子雲=より強力なロンドン分散力。
3.分子間力が強い=より高い沸点と融点。
例:
*フッ素(F2)は、原子が小さく、ロンドン分散力が弱いため、沸点(-188°C)が最も低くなっています。
*ヨウ素(I2)は、原子が大きく強いロンドン分散力を持っているため、沸点(184°C)が最高です。
特定のハロゲンを探索するか、分子間力の詳細をより深く掘り下げたい場合はお知らせください!