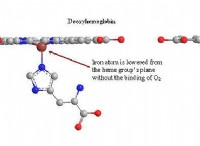
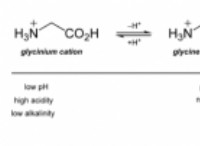
1。価電子シェル電子ペア反発(VSEPR)理論:
* 電子は互いに反発します: 電子は、結合軌道であろうと非結合軌道であろうと、負の電荷のために互いに撃退します。
* 反発の最小化: 原子は、電子ペア間の反発を最小限に抑えるために自分自身を配置し、特定の幾何学的形状をもたらします。
* 電子ペアジオメトリ: 中心原子の周りの電子ペアの配置は、電子ペアのジオメトリを決定します。
* 分子形状: 原子の位置のみを考慮して、分子の実際の形状は分子形状として知られています。
* 例:
* 四面体: メタン(CH4)-4つの結合ペア、孤立ペアなし
* 三角ピラミッド: アンモニア(NH3)-3つの結合ペア、1つの孤立ペア
* ベント: 水(H2O) - 2つの結合ペア、2つの孤立ペア
2。ハイブリダイゼーション:
* 原子軌道ミックス: 異なるエネルギーの原子軌道は、異なる形状とエネルギーを持つハイブリッド軌道を形成することができます。
* 結合を容易にするハイブリッド軌道: これらのハイブリッド軌道は、最も強いタイプの共有結合であるSigma(σ)結合の形成に適しています。
* ハイブリダイゼーションと形状: ハイブリダイゼーションのタイプは、中心原子の周りの結合の配置を決定し、分子形状に影響します。
* 例:
* SP3ハイブリダイゼーション: 四面体(CH4)
* SP2ハイブリダイゼーション: 三角平面(エテン)
* SPハイブリダイゼーション: 線形(エチン)
3。結合長と結合角:
* 結合長: 原子のサイズと結合の種類の影響を受ける2つの結合原子の核間の距離。
* 結合角: 電子ペアの数とその配置の影響を受ける2つの隣接する結合間の角度。
* 形状のバリエーション: これらの要因は、理想的なVSEPR形状からわずかな逸脱を引き起こす可能性があります。
4。分子力:
* 分子間力: 水素結合、双極子双極子相互作用、ロンドン分散力などの分子間の相互作用は、化合物の全体的な形状と立体構造に影響を与える可能性があります。
* 安定性: 分子は、これらの力を最小限に抑える立体構造を採用し、より安定した状態につながります。
5。分子コンフォメーション:
* 単一結合の周りの回転: 単一結合で接続された原子は自由に回転する可能性があり、その結果、立体構造と呼ばれる可能性のあるさまざまな配置が生じる可能性があります。
* エネルギーの違い: 異なる立体構造は異なるエネルギーレベルを持ち、一部は他のものよりも安定しています。
* 例: ブタンは、より安定したずらした立体構造や安定した食い込められた立体構造など、異なる立体構造に存在する可能性があります。
6。立体化学:
* 原子の空間配置: 立体化学は、エナンチオマー、ジアステレオマー、CIS/トランス異性体など、分子の原子の3次元配置を扱います。
* キラリティ: 補助不能な鏡像を持つ分子はキラルであり、異なる特性を示します。
* 例: アミノ酸アラニンのエナンチオマーであるLおよびD-アラニン。
要約すると、分子の形状は、電子反発、ハイブリダイゼーション、結合長、分子力を含む複雑な因子相互作用の結果です。 これらの原理は、空間内の原子の配置を支配し、多様で予測可能な分子幾何学をもたらします。