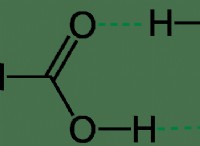
1。オクテットルール: ほとんどの原子は、8つの電子の完全な外殻を持つ貴族を模倣して、安定した電子構成を実現するよう努めています。これはOctetルールと呼ばれます。
2。価電子と結合:
* 電子の獲得または紛失: 価電子電子(通常は金属)がほとんどない原子は、安定した構成を実現するために電子を失う傾向があります。多くの価電子(通常は非金属)を持つ原子は電子を獲得する傾向があります。これにより、反対の電荷を持つイオンが生成され、互いにイオン結合を形成するために互いに引き付けます。
* 電子の共有: 中程度の数の価電子(通常は非金属)を持つ原子は、多くの場合、外側の殻を完成させるために電子を共有します。この共有は共有結合を形成します。
3。結合の予測:
* 電気否定性: 化学結合中に原子が電子を引き付ける相対的な傾向。高い電気陰性度(酸素、フッ素など)を持つ元素は、電子を引き付ける傾向があり、低電気陰性度(ナトリウム、カリウムなど)の要素とイオン結合を形成します。
* 価電子数: 同様の価電子数を持つ元素は、電子を共有して共有結合を形成できます。たとえば、4つの原子価電子を持つ炭素は、他の炭素原子または水素、酸素、および窒素と共有結合を形成します。
例:
* ナトリウム(Na)および塩素(Cl): ナトリウムには1つの価電子があり、塩素には7つあります。ナトリウムはその電子を失い、正の帯電イオン(Na+)になり、塩素が電子を獲得して負に帯電したイオン(CL-)になります。これらの反対に帯電したイオンは、イオン結合(NaCl、テーブル塩)を形成する誘引を誘致します。
* 炭素(C)および水素(H): 炭素には4つの価電子があり、水素には1つあります。それらは電子を共有して共有結合を形成し、メタン(CH4)のような分子を作成します。
重要なメモ:
* オクテットルールの例外: 水素(2つの電子が必要)、ベリリウム(4つの電子が必要)、ホウ素(6つの電子が必要)などの一部の元素は、オクテットのルールに従わないでください。
* 遷移金属: 遷移金属は、d軌道を含むより複雑な結合挙動を持ち、その結合は、その原子価電子によってのみ決定されるわけではありません。
要約すると、オクテットのルールと電気陰性度と組み合わせた元素内の原子価電子の数を理解することは、要素が形成できる化学結合の種類と、どの他の要素と結合する可能性が高いかについての洞察を提供します。