あなたは今まで酸と塩基について読んできました。うまくいけば、酸と塩基を含む多くの実験に出くわすでしょう。したがって、あなたはそれらの特性にも気づいています。同じ順序で、硫酸を使った実験はもう行ったことがありますか?濃酸に水を加えるのを先生が止めた理由を考えたことはありますか?家庭でも硫酸が使われているのをご存知ですか?
次のセクションでは、硫酸、その特性、およびその用途について詳しく学びます。
硫酸とは?
硫黄は、H₂SO₃、H₂S₂O₃、H₂S₂O₄、H₂SO₅ などの多くのオキソ酸を形成します。それらのいくつかは安定していますが、不安定で分離できないものもあります。これらの硫黄のオキソ酸は、水溶液またはその塩の形で存在します。
硫酸もその一つです。硫黄のすべてのオキソ酸の中で、それは最も重要な酸です。硫酸は、硫酸二水素塩、ビトリオール油、マトリング酸、バッテリー酸、浸漬酸、および硫酸の使用に応じて他の多くの名前としても知られています.古来、硫酸は緑色のビトリオール (硫酸第一鉄)、FeSO4.7H2O を蒸留することによって調製されたため、「ビトリオールの油」と呼ばれていました。

硫酸の構造
これは二塩基酸であるため、2 つの OH 基が含まれています。これらのグループは両方とも S 原子に直接結合しています。したがって、硫酸 H2SO4 は式 (OH)2SO2 で表すこともできます。 2 つの OH 基の存在は、H2SO4 が PCl5 と反応すると、H2SO4 分子に存在する 2 つの OH 基が 2 つの Cl 原子に置き換えられるという事実によって確認されます。その結果、塩化スルフリル(Cl2SO2)が得られる。他の多くの反応で、H₂SO₄ の構造の S 原子に直接結合した 2 つの OH 基の存在を確認できます。
これらの事実に基づいて、H₂SO₄ には 2 つの構造があります。1 つは 2 つの二重結合を持ち、もう 1 つは 2 つの配位結合を持ちます。
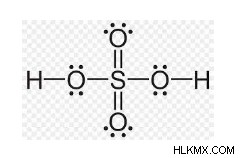
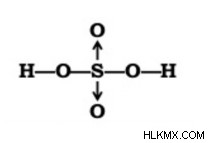
H2SO4 分子のこれら 2 つの構造は共鳴状態にあると考えられます。硫酸は四面体構造を持っており、硫黄は +6 の酸化状態で sp³ 混成しています。
硫酸の製造
現在、硫酸の製造には 2 つのプロセスがあります。これらは
1.リード チャンバー プロセス:
このプロセスでは、SO2、空気、および NO の混合物を水蒸気 (H2O) で処理すると、硫酸が生成されます。このプロセスでは、NO が触媒として機能します。
化学反応は次のように起こります
2SO₂ + O₂ (空気から) + 2H₂O + [NO] → 2H₂SO₄ + [NO]
2.連絡方法:
このプロセスには次の手順が含まれます:
- ステップ 1: SO₂ の準備
S + O₂ → SO₂
- ステップ 2: SO₂ から SO₃ への酸化
2SO₂ + O₂ ⇌ 2SO₃
この反応は、触媒の存在下で起こります。 Pt-アスベスト、V₂O₅、または Fe₂O₃ のいずれかです。
- ステップ 3: SO₃ の 98% H₂SO₄ への溶解
SO₃ + H₂SO₄ → H₂S₂O₇
- ステップ 4: 水による発煙硫酸の希釈
H₂S₂O₇ + H₂O → 2H₂SO₄
硫酸の物理的性質
- 純粋な硫酸は、無色で濃く、重く、シロップ状の油状の液体です。
- 15℃での密度は 1.84 で、発煙しません。
- 沸点は 340℃、無色の結晶は 10.38℃で溶けます。
- 硫酸分子間の水素結合は、高い沸点と粘度を示します。
- 水によく溶けます。水を加えると、非常に発熱反応を示します。
- 電気と熱の伝導体です。
- 組織や金属に対して非常に腐食性があります。したがって、皮膚の硫酸は火傷を引き起こします。
- 接触すると木材やその他の有機物を燃やしますが、火災は引き起こしません。
- 高濃度の硫酸を吸入すると、健康に深刻な影響を与える可能性があります。
硫酸の化学的性質
1.解離:
H₂SO₄ を加熱すると、水蒸気 (H₂O) と SO₃ に解離します。
H₂SO₄ ⇌ H₂O + SO₃
2.酸性の性質:
酸の水溶液は、2 段階でイオン化して 2 つの H + イオンを生成するため、強い二塩基酸として振る舞います。たとえば、
H₂SO₄ ⇌ 2H⁺ + SO₄⁻
3.酸化剤:
高温の濃硫酸は強力な酸化剤として作用します。これは、H2SO4 が発生期の酸素を非常に容易に失う可能性があるためです。 H₂SO₄ が物質を酸化すると、SO₂ に還元されます。これらの酸化特性は、H₂SO₄ の希釈では不可能です。
H₂SO₄ → H₂O + SO₂ + [O]
4.脱水剤:
濃縮された H2SO4 は水に溶解し、硫酸水和物 H2SO4.nH2O を形成します。この特性により、濃縮 H2SO4 は脱水特性を示します。たとえば、
(COOH)₂ + H₂SO₄ → CO + CO₂ + [H₂SO₄.H₂O]
5.沈殿反応:
カルシウム、バリウム、鉛などの塩の水溶液を希硫酸で処理すると、対応する金属硫酸塩の白い沈殿物が形成されます。たとえば、
BaCl₂ + H₂SO₄ → BaSO₄ ↓ + 2HCl
6.電気分解:
50% H2SO4 を電気分解すると、溶液中の陽極でペルオキシ二硫酸 (H2S2O8) が得られます。
7.塩に対するアクション:
H₂SO₄ は、炭酸塩、亜硫酸塩、硝酸塩、塩化物などの揮発性の高い酸の塩を分解する強酸です。いずれの場合も揮発性の高い酸が遊離します。たとえば、
2NaCl + H₂SO₄ → Na₂SO₄ + 2HCl
中和硫酸
硫酸の中和プロセスは、細心の注意を払って慎重に行う必要があります。以下の手順に従ってください。これらは硫酸の中和に役立ちます。
- 硫酸がこぼれる場所に重曹を直接注ぎます。
- 濃硫酸部分に水を加えないでください。条件を悪化させます。
- 硫酸を中和するには、NaOH などの強塩基を使用します。ただし、より大きなこぼれの原因となるため、その解決策は使用しないでください。
- こぼれた場所に砕いた氷を十分に注ぎます。
- 衣服にこぼれた場合は、できるだけ早く脱ぎ、流水で洗い流してください。
硫酸の用途
硫酸は、家庭だけでなく産業でもさまざまな目的で使用されています。硫酸はさまざまな用途があるため、「化学薬品の王様」と呼ばれることがよくあります。硫酸の商業用途の一部は次のとおりです。
- (NH₄)₂SO₄、アモルファス、アンモニア化リン酸硫酸塩、過リン酸石灰、K₂SO₄などのさまざまな肥料の製造に使用されます。
- HCl、H₃PO₄、HNO₃などの他の酸を製造します。
- ニトログリセリン、トリニトロトルエン (TNT)、ピクリン酸、銃綿、ダイナマイトなどの爆薬の製造に使用されます。
- 硫酸は、ミョウバン、金属硫酸塩、エーテル、リン、Na₂CO₃などの多くの化学物質を製造します。
- 石油の精製に使用されます。
- 金属を精製するための多くの冶金プロセスで使用されます。
- 硫酸は、コール タール、染料、およびいくつかの薬品や消毒剤の製造に役立ちます。
- 繊維、紙、染色産業を支援します。
- 皮革産業のなめしに役立ちます。
- 電気メッキ、エナメル、亜鉛メッキなどの前に金属を洗浄するために使用されます。
- 蓄電池に使われています。
家庭での硫酸の使用
商業目的のために、硫酸は家庭で使用されています。家庭での一般的な硫酸の使用のいくつかは
- 自動車のバッテリーに含まれています。
- 一部の排水管クリーナーで使用されています。
- 粉末洗濯ハンドソープ、洗剤、ペット用品、食器用洗剤の添加物です。
- アルミニウムをきれいにする製品などの家庭用クリーニング製品によく見られます.
結論
硫酸は最も一般的な酸です。さまざまな化学実験、産業、家庭で高く使用されています。ほぼすべての業界で必要とされるさまざまな化合物を作るために採用されています。強い無機酸です。
注意して使用すれば、有益な場合があります。しかし、予防策を講じないと、あなたに害を及ぼす可能性があります。深刻な健康問題を引き起こしたり、死に至ることさえあります。そのため、適切な注意と注意を払い、専門家の監督の下で使用することをお勧めします。
よくある質問
<強い>1.硫酸の有害な影響は何ですか?
<オール>- 硫酸 (H₂SO₄) は目、皮膚、肺、歯に有害な腐食性物質です。
- 急性曝露は死に至る可能性があります.
- 濃縮 H₂SO₄ は、多くの化学物質と接触すると発火または爆発する可能性があります。
<強い>2.水が硫酸に加えられると、プロセスは発熱になります。なぜですか?
A. 酸に水を注ぐと大量の熱が発生します。したがって、温度は120℃まで上昇します。発生する熱は非常に大きいため、酸が容器から噴出します。したがって、酸を希釈する場合は、酸に水を加えるのではなく、常に攪拌しながらゆっくりと水に加える必要があります。
<強い>3.労働者が硫酸にさらされるリスクがあるのはどのような場所ですか?
A. 労働者が危険にさらされている場所のいくつかは
- 汚れたバッテリーを持ち上げるメカニック
- アウトドア ワーカーは、石油、石炭、またはガスが燃焼する地域で働きます。
- 印刷、出版、または写真店の労働者
- 水を混ぜた便器洗浄剤に関連する請負業者および配管工
- 酸の霧にさらされる鉄鋼労働者と消防士
<強い>4.皮膚の硫酸は何を引き起こしますか?
A. 肌への硫酸の影響は次のとおりです。
- 痛み、やけど、発赤、水ぶくれを引き起こす可能性があります。
- 皮膚に大量の硫酸が付着すると、永久的な瘢痕が残る可能性があります。
- 重度にさらされると死に至ることさえあります。
- 皮膚に接触すると、皮膚が乾燥して赤くなったり、ひび割れたりすることがあります (皮膚炎)。