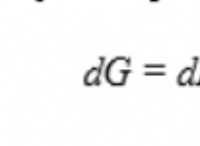1。制限反応物および過剰反応物:
* 制限反応物: 反応で最初に完全に消費される反応物。形成できる製品の最大量を決定します。
* 過剰反応物: 制限反応物との完全な反応に必要な量よりも多く存在する反応物。 その一部は未解決のままです。
製品組成への影響:
* 化学量論: バランスの取れた化学式の化学量論係数は、反応物と生成物のモル比を表しています。 制限反応物は、これらの比率に従って形成される製品の量を決定します。
* 製品収量: 形成される製品の量は、制限反応物の量に直接比例します。制限反応物を増やすと、反応が完了に達する地点まで、製品の収率が増加します。
* 過剰反応物: 過剰な反応物の量を増やしても、制限反応物が最大収率を決定するため、形成された生成物の量は変わりません。ただし、過剰な反応物は反応速度に影響を与える可能性があります。
2。平衡反応:
* le Chatelierの原則: この原則は、条件の変化が平衡状態のシステムに適用される場合、システムはストレスを緩和する方向にシフトすると述べています。
* シフト平衡: 反応物または生成物の量を変更すると、平衡位置がシフトし、平衡状態での産物と反応物の相対量の変化につながる可能性があります。
例:
* メタンの燃焼: CH4 + 2O2→CO2 + 2H2O
*メタン(CH4)の量を増やすと、酸素が過剰であると仮定して、生成された二酸化炭素(CO2)と水(H2O)の量を増やします。
* haberプロセス(アンモニア合成): N2 + 3H2⇌2NH3
*窒素(N2)または水素(H2)の量を増やすと、平衡が右にシフトし、より多くのアンモニア(NH3)の産生を支持します。
キーポイント:
* 化学量論は重要です: バランスの取れた化学式は、反応物と生成物の量との関係を理解するために不可欠です。
* 制限反応物コントロール収量: 形成される製品の量は、最終的に制限反応物によって決定されます。
* 平衡反応は動的です: 反応物濃度の変化は、平衡をシフトし、製品の組成に影響を与える可能性があります。
要約:
化学反応における反応物の量を変更すると、製品の組成に大きな影響を与える可能性があります。制限反応物、製品の収量、可逆反応における平衡位置に影響します。これらの関係を理解することは、化学反応の結果を予測して制御するために重要です。