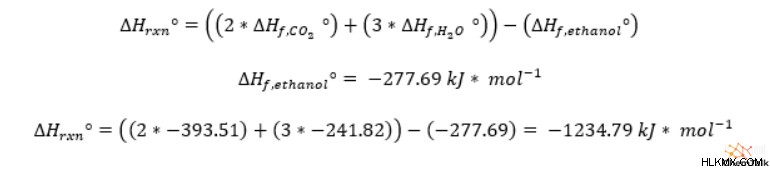コア コンセプト
この記事では、エンタルピーの基礎と、生成エンタルピーを使用して反応エンタルピーと燃焼エンタルピーを計算する方法を学びます。
エンタルピー
化学者と物理学者は、エンタルピーの変化を一定圧力でのシステムの熱交換と定義する傾向があります.
エンタルピーは、化学反応を含むプロセスが発生する可能性があるかどうかを通知するため、重要な熱力学的概念です。具体的には、化学者はしばしばギブズ自由エネルギーを使用して、反応の好意性または自発性を表します。エンタルピーは、方程式で示されるように、ギブスの自由エネルギーと直接関係があります。
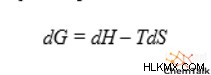
ギブスの負の変化は自然反応を示すため、エンタルピーの負の変化を含む多くの「発熱」反応は自然発生する傾向があります。エンタルピーが正の変化を示す「吸熱」反応の場合は逆になります。化学反応を熱力学的に記述する上でエンタルピーが重要であるため、化学者はエンタルピーを測定および計算する多くの方法を決定しました。
形成エンタルピー
反応エンタルピー (または「反応熱」) を計算する最も一般的な方法の 1 つは、化学者が生成エンタルピー (または「生成熱」) と呼ぶものを使用することです。文脈上、各分子には特徴的な生成エンタルピーがあります。このエンタルピーは、本質的に分子内の各結合の合計エネルギーを表します。別の言い方をすれば、分子の形成エンタルピーは、その最も基本的な成分から分子を形成する際の熱です。
たとえば、6 モルの元素状炭素と 7 モルの H2 からヘキサン (C6H14) を形成する反応を取り上げます。この反応によって放出される熱は、一定の圧力下で、ヘキサンの生成エンタルピーに等しくなります。
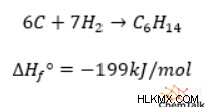
上記の形成エンタルピーの値は、「標準条件」の下でのみ適用されることに注意することが重要です。具体的には、摂氏 20 度 (または 298.15K) の温度と 1 気圧の圧力です。コンテキストでは、「標準温度と圧力」の「STP」と省略された標準条件がよく見られます。非標準的な条件下で反応が起こると、生成エンタルピーが変化します。標準状態を仮定するすべてのエンタルピーには、度の表記と同様に、上付き文字に小さな円があります。
重要なことに、すべてのエンタルピーは化学者が状態関数と呼ぶものであり、2 つの状態間のエンタルピーの変化は、2 つの状態間で取られる中間ステップに関係なく、状態のエンタルピー間の差に等しいということです。したがって、炭素と水素の間のメカニズムに関係なく、-199kJ/mol のエンタルピー変化が標準条件下で常に発生します。
反応エンタルピー
生成エンタルピーを使用すると、特定の温度での化学反応のエンタルピー変化を計算できます。重要なことに、反応エンタルピーを計算する方法はたくさんあります。いくつかの例には、結合エンタルピーまたは周囲への温度変化の使用が含まれます。ただし、反応がよく知られた条件下でよく知られている反応物を含む場合、必要な生成エンタルピーはオンラインで存在します。このような場合、かなり単純な式で、生成エンタルピーから最も簡単に反応エンタルピーが得られます。
反応エンタルピーを計算するには、各反応物の生成エンタルピーに、平衡化学式の反応物の化学量論係数を掛ける必要があります。次に、生成物と反応物の乗算されたエンタルピーを別々に追加する必要があります。最後に、生成物から反応物の合計エンタルピーを差し引いて、全体の反応エンタルピーを求めます。
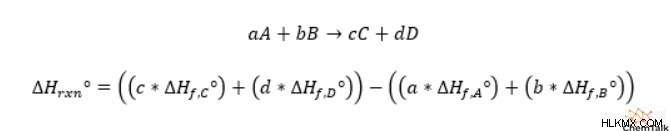
興味深いことに、化学者は、生成物の合計値から反応物の合計値を差し引くこのプロセスを使用して、反応のエントロピーや反応のギブズ自由エネルギーなど、他の多くの状態変数の全体的な反応値を計算します。化学者は、スイスの化学者 Germain Hess にちなんで、状態変数の変化を計算するこの方法を Hess の法則と呼んでいます。多くの化学の学生は、ヘスの法則に関連する式を覚えるために、「生成物から反応物を差し引いたもの」というフレーズを覚えています。
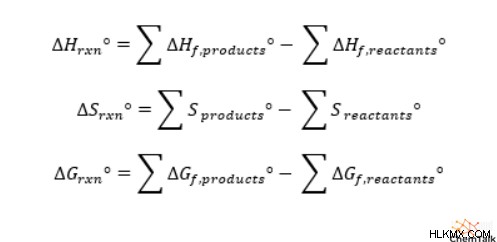
実際の例を見てみましょう。
反応のエンタルピーの例:二酸化窒素の分解
二酸化窒素は、次の化学反応に従って一酸化窒素と二原子酸素に分解することがあります:
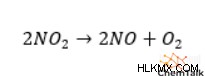
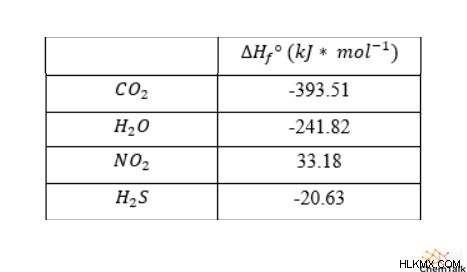
標準的な条件下では、二酸化窒素と一酸化窒素の生成エンタルピーは、それぞれ 33.18kJ/mol と 90.25kJ/mol です。酸素元素は二原子酸素として自然に発生するため、O2 の生成エンタルピーはゼロです。
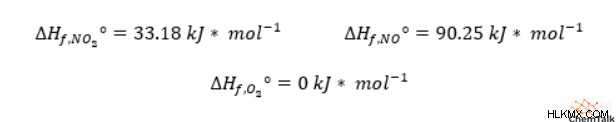
反応エンタルピーを計算するには、二酸化窒素と一酸化窒素の両方の生成エンタルピーに 2 を掛ける必要があります。これは、バランスの取れた化学式でどちらも化学量論係数が 2 であるためです。次に、二酸化窒素 (「生成物」) のエンタルピーの倍数を取り、一酸化窒素 (「反応物」) のエンタルピーの倍数を差し引いて、「1 モルの反応」あたり 114.14 キロジュールの全体的な反応エンタルピーを取得します。この正の反応エンタルピーは、二酸化窒素の分解が吸熱的であることを示しています。

重要なことに、ここでの「1 モルの反応」とは、2 モルの二酸化窒素の分解を指します。これは、二酸化窒素に係数 2 を与える平衡方程式を使用して反応エンタルピーを計算したためです。代わりに、1 モルの二酸化窒素の分解の反応エンタルピーを知りたい場合は、計算したエンタルピーを単純に 2 で割ることができます。 、それは「半モルの反応」になるからです。同様に、4 モルの二酸化窒素、つまり「2 モルの反応」に対して同じことをしたい場合は、値を 2 倍します。
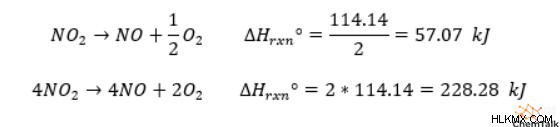
燃焼エンタルピー

燃焼反応は、化学者が生成エンタルピーから反応エンタルピーを計算するためにヘスの法則を使用する最も一般的な反応タイプの 1 つです。重要なことに、「燃焼エンタルピー」という用語は、特に燃焼中の分子に関する、そのような反応エンタルピーに使用されます。たとえば、化学者は「ヘキサンの燃焼エンタルピー」というフレーズを使用して、ヘキサンの燃焼反応に関連する標準的な反応エンタルピーを説明します。
燃焼エンタルピーを計算するときは、反応エンタルピーと同じ規則が適用されますが、異なる燃焼反応はしばしば同じ生成物を持つという追加の利点があります。炭化水素の場合、生成物には一般に二酸化炭素と水のみが含まれますが、分子内の炭素と酸素の数によって量が異なる場合があります。燃焼分子に窒素または硫黄が含まれている場合、燃焼により二酸化窒素と硫化水素も生成される可能性があります。
別の例を見てみましょう。今回は燃焼反応です。
燃焼反応のエンタルピーの例:エタノール燃焼
1 分子のエタノールが標準的な条件下で燃焼すると、次の式に従って、反応により 2 つの二酸化炭素と 3 つの水分子が生成されます。
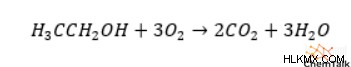
したがって、燃焼反応のエンタルピーを得るには、化学量論係数で重み付けされた生成物の形成エンタルピーを合計し、エタノールの形成エンタルピーを引きます。その結果、エタノールの標準燃焼エンタルピーは -1234.79kJ/mol になります。