さまざまな物理的、化学的、および生化学的プロセスにおける非共有相互作用の役割はよく知られており、その性質に多くの研究者を惹きつけています [1-5]。これは、さまざまな非共有相互作用を理解し特徴付けるための計算化学の最近の主要な関心事の 1 つになっています。
これらの非共有相互作用の中で、水素結合は、プロトン移動反応、結晶工学などにおいて、さまざまな超分子フレームワークの安定化に重要な役割を果たしているため、主に分析されています [6-9]。しかし、最近、ハロゲン置換 (ほとんどがフッ素) 分子は、他のタイプの相互作用の役割を増大させることが判明しており、実験研究と理論研究の両方の領域が拡大しつつあります [10-13]。
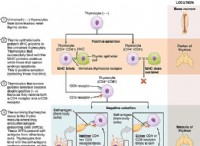
ベンゼンと水との相互作用は、水の水素原子とベンゼンのπ雲を介して行われますが、水とフッ素化ベンゼンとの相互作用は、水の酸素原子とベンゼンのベンゼンのπ雲の孤立電子対を介して行われます (Scheme 1)。この孤立したペア-π 相互作用は、最近、理論的にも実験的にも検証されました [12]。孤立電子対対π相互作用の最初の実験的証拠は、2004 年に Reedijk と共同研究者によって Cl とピリジン間の複合体で提供されました [14]。 Meyer と共同研究者 [15] は同年、Cl- とトリアジンの間の安定化相互作用の実験的証拠を報告し、この分野でのさらなる理論的および実験的調査に火をつけました。最近、回転分光法と理論計算を組み合わせることで、水の酸素原子とフッ素化ベンゼンのπ雲との間の孤立電子対-πホール相互作用の明確な証拠が得られました (スキーム 1b) [12,16]。
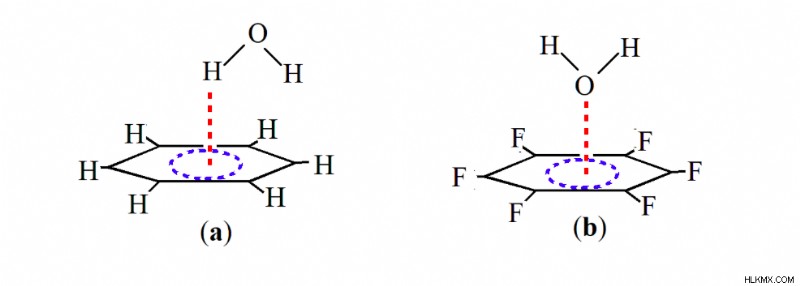
この孤立電子対-π相互作用の形成は、フッ素原子の誘導効果によって促進されます。これにより、ベンゼン環から電子密度が引き出され、分子骨格に垂直な領域に「穴」が作成されます。この穴のこの領域は、酸素原子の孤立電子対を引き付けることができ、この孤立電子対-π 相互作用の形成につながります。したがって、この孤立したペア-π 相互作用も、多くの超分子フレームワークを安定化する際に従来の水素結合と競合しているようです。この発見に着想を得て、スキーム 2 に示すように、いくつかの選択した分子の構造、エネルギー、および電子密度のトポロジーに関する詳細な理論的研究を行いました。この研究で検討する分子は、ベンゼン (B)、ヘキサフルオロベンゼン (HFB) です。 、ヘキサシアノベンゼン (HCB)、および 1,3,5-トリニトロベンゼン (TNB) であり、孤立電子対および H2 などの水素結合供与体との相互作用を考慮しました。 お、NH3 、HF および HCl。
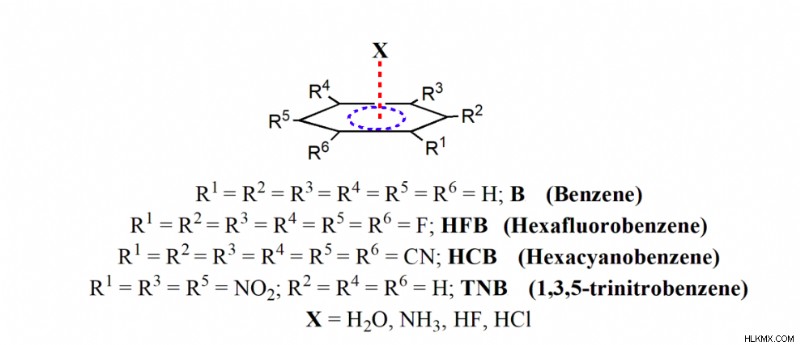
これらの分子とベンゼンとの相互作用は、H2 の H 原子を介して行われます。 お、NH3 、HF、HCl、およびベンゼンのπ雲は、ベンゼンのπ雲がこれらの分子の電気陽性のH原子を引き付ける電子密度の山のように作用していることを意味します.一方、F、CN、NO2 などの電子求引性置換基の導入 などをベンゼンに結合すると、芳香族表面が電子不足になり、H2 の非共有電子対領域が引き付けられます。 お、NH3 、HF、HCl分子。したがって、これらの置換ベンゼンの芳香族表面は山のように機能しています。静電気と分散の両方が、引力的相互作用の支配的な要因です。分散相互作用の優位性は、H2 の自由回転を示しています。 お、NH3 、HF、および HCl 分子であり、これも最近の実験的観測 [12] と一致しています。
これらの発見は、「ベンゼンおよび置換ベンゼンにおける非共有結合相互作用:理論的研究」という題名の記事で説明されており、最近ジャーナル Computational and Theoretical Chemistry に掲載されました。 この作業は、コットン大学の Chayanika Kashyap、Sabnam S. Ullah、Lakhya J. Mazumder、および Ankur Kanti Guha によって実施されました。
参考文献:
<オール>