硫化水素または硫化水素とも呼ばれる硫酸水素塩は、腐った卵のにおいがする無色の気体です。硫化水素は、毒性、可燃性、腐食性があることで知られています。硫化水素の化学式は H2S です。
硫化水素に関する一般的な事実
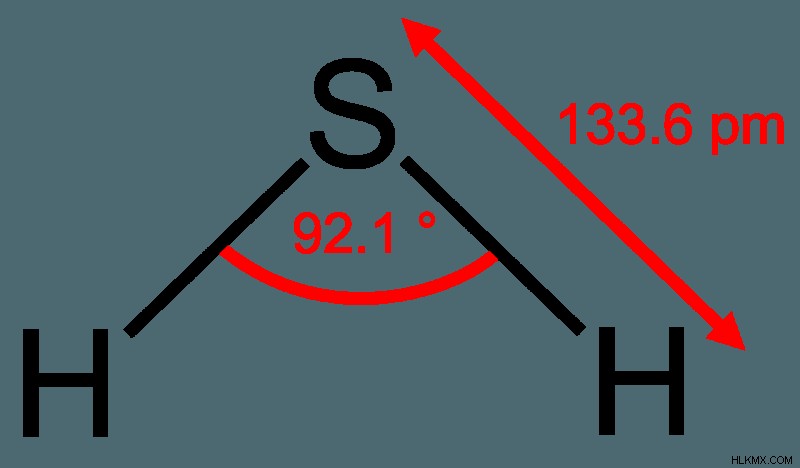
化学式:H2S
外観:硫化水素は完全に無色の気体です。
沸点:摂氏-60度
融点:摂氏-82度
酸度:7.0
密度:1.363 g dm-3
際立った特徴:腐った卵のようなにおい。
硫化水素の性質
硫化水素は、水素原子2個と硫黄原子1個からできています。硫化水素は通常の空気よりも密度が高く、酸素と一緒に燃焼すると青い炎が発生します。硫化水素が燃焼すると、水と二酸化硫黄が生成されます。硫化水素は、還元剤、酸化還元化学反応の過程で別の化学物質に電子を放出する化合物または元素として機能します。
硫化水素と二酸化硫黄は、触媒と結合したり高温で反応したりすると、互いに反応して水と硫黄を生成します。この反応は、産業操作で硫化水素を処理するために利用されます。
硫化水素は弱酸として機能し、水に溶けますが、水によく溶けません。空気と混合すると、溶液は酸化し、水に溶けない硫黄を生成します。硫化水素は水に似た構造を持っていますが、硫黄の電気陰性度は酸素ほどではありません。つまり、硫化水素は水よりもはるかに極性が低いということです。硫化水素は極性が低いため、硫化水素の融点と沸点は水の沸点よりも大幅に低くなります。硫化水素は -60.7°C で沸騰しますが、水は 100°C で沸騰します。
純粋な硫化水素は無色で、それを含む溶液も無色です。硫化水素は、金属イオンと反応すると金属硫化物を形成します。これらの金属硫化物は通常、色が濃く、水に不溶です。金属硫化物を強酸で処理すると、硫化水素が放出されます。
90 ギガパスカル以上の圧力をかけると、硫化水素の分子は電気を通すことができます。高圧の硫化水素は、臨界温度以下に冷却されると超伝導を示します。圧力が上昇すると、臨界温度も上昇します。硫化水素の臨界温度は、100 ギガパスカルで 23K から 200 ギガパスカルで 150K の間です。
硫化水素の臭いは非常に強力で、約 2 ppb のレベルで検出できます。参考として、20 ppb の濃度は、100 席の大学の講堂に均等に分配された 1 mL のガスに相当します。
硫化水素の生産
硫化水素は通常、サワーガスから分子を分離することによって生成されます。サワーガスは、その中に高濃度の硫化水素を含む単なる天然ガスです。ただし、硫化窒素は、約 450°C の温度で溶融硫黄を水素と結合させることによっても生成できます。この操作中に炭化水素から水素を得ることができます。
硫酸還元バクテリアはまた、老廃物として硫酸水素を生成します。これらの細菌は、さまざまな硫酸塩を使用して水素またはさまざまな有機化合物を酸化することにより、低酸素環境でエネルギーを生成します。硫化水素を生成する別の方法は、硫化物を水にさらすことによって行うことができる、硫化リンや硫化アルミニウムなどの非金属および金属硫化物から硫化水素を遊離させることです。硫化水素ガスは、硫化水素を生成する硫黄バクテリアのために持続可能な暖かい環境が作られるという事実のおかげで、給湯器が使用されている場合、亜硫酸塩からより簡単に得ることができます.
天然ガスは最大 90% の硫化水素で構成されているため、天然ガスの収集は硫化水素を取得する主要な方法の 1 つになっています。硫化水素は、原油にも少量含まれています。天然の温泉や火山の中には、加水分解の産物である可能性が高い硫化水素を大量に放出するものもあります。硫酸塩を還元するバクテリアは、井戸水で硫化水素を生成することもできます。石油精製所は、硫化水素の最大の産業発生源です。
硫化水素は、非酵素的経路または酵素的経路のいずれかを介して、体の細胞によって生成されます。体内で生成される硫化水素のほとんどは酵素経路で作られますが、非酵素経路では、リーゼケタンパク質やフェレドキシンなどのタンパク質を使用して硫化水素が生成されます。人体は、硫黄を含むタンパク質を分解することにより、少量の硫化水素を生成します.
硫化水素の用途
硫化水素は、主に元素硫黄を得るための触媒として利用されます。硫化水素は、エタンチオールやメタンチオールなど、さまざまな有機硫黄化合物の製造に使用されます。硫化水素がアルカリ金属塩基と結合すると、水硫化ナトリウムや硫化ナトリウムのようなアルカリ水硫化物に変換されます。硫化ナトリウムやその他のアルカリ水硫化物の主な用途の 1 つは、紙のマーキングのプロセスです。
多くの金属硫化物は、金属イオンと硫化水素の組み合わせによって生成されます。この金属硫化物変換の用途には、汚染された水またはガスの洗浄が含まれます。硫化水素は、多くの場合、鉱物粉末を処理し、浮遊選鉱プロセス中に金属鉱石の分離を促進するために使用されます.
硫化水素ガスは、少量を細胞に適用すると、ミトコンドリアの損傷を食い止めることができます。硫化水素は、通常の水から重水または重水素酸化物を分離するためにもよく使用されます。
硫化水素の危険性

硫化水素は可燃性で、時には爆発性、腐食性、毒性があります。
硫化水素は広範囲の毒物であるため、体内のさまざまなシステムや臓器に損傷を与える可能性があります。しかし、硫化水素は神経系に最も深刻な影響を与える傾向があります。硫化水素中毒は、損傷という点では一酸化炭素中毒に匹敵し、同様に細胞呼吸を妨げます。
体は自然に硫化水素を生成するため、体内には硫化水素を解毒するいくつかの酵素が腸内に存在します.硫化水素は 50 ppm 前後で体に重大な損傷を与え始めると考えられており、労働安全衛生協会によると 20 ppm が許容上限濃度です。硫化水素は空気より重いため、換気の悪い場所に頻繁に蓄積し、床に沿って致命的な濃度で集まります.
低濃度の硫化水素は、息切れ、肺水腫、咳、喉の痛み、目の炎症などの問題を引き起こす可能性があります.これらの症状は通常、数日から数週間で自然に治ります。しかし、長期にわたる硫化水素暴露のレベルがさらに低くても、頭痛、記憶力の低下、めまい、疲労を引き起こす可能性があります. 300 ppm を超える濃度では、重度の肺水腫、呼吸困難、および死亡の可能性が発生する可能性があります。
硫化水素の環境への影響
硫化水素は硫黄サイクルの主要な構成化学物質の 1 つであり、これは地球全体で硫黄を循環させる非生物的および生物的経路を指します。
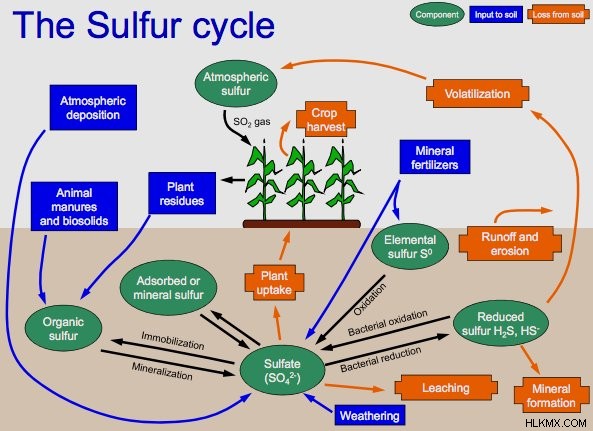
硫黄循環には 4 つの段階があります。第 1 段階では、有機硫黄から硫化水素などの無機形態の硫黄を生成します。第 2 段階では、これらの無機形態の硫黄の酸化が行われ、硫化物、元素硫黄、および硫酸塩が紫色および緑色の硫黄バクテリアによって酸化されます。この後、硫酸塩から硫化物への還元、具体的には異化硫黄還元があります。最後に、硫化物は、金属を含む硫化物誘導体を含むさまざまな有機化合物に組み込まれます。
低酸素状態で有機物が腐敗すると、硫黄または硫酸塩を還元するバクテリアが、環境に存在する硫酸塩を使用してこの有機物を酸化および分解します。このプロセスでは、副産物として硫化水素が生成されます。この硫化水素は、金属イオンと結合して金属硫化物を形成します。

一方、他のバクテリアは、硫黄を含むアミノ酸から硫化水素を取り除きます。緑色硫黄細菌と紫色硫黄細菌は、光合成の過程で硫化水素を電子供与体として利用することにより、元素硫黄を生成します。
ほとんどの動物は硫化水素にさらされると損傷を受けますが、極限環境微生物のいくつかの種は、硫化水素が豊富な環境で生きて繁栄することができます.たとえば、硫化水素を排出する熱水噴出孔の周囲には、多くのバクテリアや魚が生息しています。同様に、硫化水素レベルの高い淡水泉があり、これらの泉には少数の魚種や無脊椎動物が生息しています。