大気中に最も多く存在するガスはどれか分かりますか?窒素?はい!窒素は大気中に最も多く存在する気体です。大気中の体積の約 78% を占めています。
窒素は、二原子、すなわち、二窒素または N2 の形で発生します。周期表を読んで、その名前が最初のメンバーのほとんどのグループを一般的に知っていることに気付きました.では、窒素ガスを含むグループの名前を推測できますか?窒素が水素と反応するとどうなりますか?このようにして形成された製品に付けられた名前は何ですか?アンモニアとは?その特性は何ですか?
このセクションは、窒素と水素が反応して生成される生成物であるアンモニアについて詳しく学ぶのに役立ちます。
アンモニアとは?
窒素の電気陰性度とサイズが小さいため、他の周期表元素と多くの化合物を形成できます。アンモニアもその一つです。独自の特性と用途があります。
アンモニアとは?アンモニアは、窒素と水素の間の結合または反応によって形成される生成物または化合物です。これは、これら 2 つの要素によって形成される最も単純な化合物の 1 つです。アンモニアの分子式は NH₃ です。
土壌や空気中に少量存在します。土壌中では、窒素を含む有機物、すなわち尿素が分解されて生成されます。アンモニアには、多くの環境および産業用途があります。多くの医薬品や洗浄剤の構成要素です。
アンモニアの構造
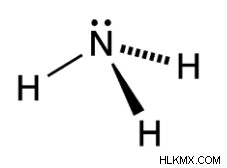
ルイス構造によると、窒素原子は 4 つの電子対に囲まれています。これらの 4 つの電子対には、3 つの H 原子と 1 つの孤立電子対 N 原子を持つ 3 つの結合対が含まれます。その結果、N 原子四面体の周りにこれらの 4 つの電子対の空間配置が形成されます。
四面体の 4 つの頂点の 1 つに 1 つの孤立したペアがあるため、孤立したペア間の結合ペア反発が発生します。この反発力は結合ペア間の反発力よりも大きいため、アンモニアの結合角は 109.5° から 107.5° に減少します。したがって、アンモニア式 NH3 分子の形状は四面体ではなく、歪んで三方錐体になります。
アンモニアの準備
アンモニアを調製するには、実験用と商用の 2 つの方法があります。
1.実験方法:
- 硫酸アンモニウムと水酸化ナトリウム (または他の強塩基) を加熱することにより
(NH₄)₂SO₄ + 2NaOH + 熱 → 2NH₃ + 2H₂O + Na₂SO₄
- 消石灰と塩化アンモニウムを加熱する
2NH₄Cl + Ca(OH)₂ + 熱 → 2NH₃ + 2H₂O + CaCl₂
- 水が金属窒化物と反応するとき
Mg₃N₂ + 6H₂O → 3Mg(OH)₂ +2NH₃
2.商業的方法:
工業規模では、アンモニアはハーバーのプロセスによって製造されます。
N₂ (g) + 3H₂ (g) ⇌ 2NH₃ (g)
この反応は、低温、高圧、触媒の存在下で可能です。
アンモニアの物理的性質
- 予測可能な刺激臭のある無色の気体です。
- 目に涙が出ます。
- アンモニアの化学式はNH₃です。
- アンモニアのモル質量は 17.031 g/mol です。
- アンモニアの密度は 0.68 g/cm³ です。したがって、空気より軽いです。
- 水に非常に溶けやすい
- 液体アンモニアは 239.6K で沸騰し、融点は 198.4K です。
- 加圧下で冷却すると簡単に液化します。
- 加圧下で冷却すると簡単に液化します。
- 気化すると、液体アンモニアは激しい冷却を引き起こします。
アンモニアの化学的性質
- 基本的な性質を持っています。ただし、この基本的な性質は非常に弱いですが、OH⁻ イオンの形成によるものです。
- 重金属塩溶液と反応し、水酸化物沈殿物を形成します。
FeCl₃ + 3NH4OH → Fe(OH)₃ ↓ + 3NH4Cl
- ルイス塩基として動作します。
NH₃ + BF₃ → H₃N→BF₃
- 臭素水に通すと窒素に酸化されます。
8NH₃ + 3Br₂ → N₂ + 6NH₄Br
- 次亜塩素酸ナトリウムで酸化され、ヒドラジンを形成します。
2NH₃ + NaOCl → NH₂.NH₂ + NaCl + H₂O
- 液体アンモニアは、多くの化学反応で溶媒として機能します。
2NH₃ ⇌ NH₄⁺ + NH₂⁻
- ナトリウムやカリウムなどの溶融金属の上を通過すると、アミドを形成し、水素ガスを放出します。
2Na + 2NH₃ → 2NaNH₂ + N₂
- 窒素の電気陰性度が高いため、N-H 結合は非常に極性があります。したがって、アンモニア式 NH3 分子は、分子間水素結合を受けます。
アンモニアの使用
アンモニアにはさまざまな用途があります。それらのいくつかは
- ソルベイのプロセスでは、炭酸ナトリウムの製造にアンモニアが使用されます。
- オストワルドのプロセスでは、硝酸NH₃の製造方法が採用されています。
- アンモニアは、硝酸アンモニウム、硫酸アンモニウム、リン酸二アンモニウム、尿素などの肥料の製造に使用されます。
- レーヨンと尿素の製造に使用されます。
- アンモニアは、ガラスの表面や家具からグリースなどを除去するための洗浄剤として使用されます。
- アンモニアはアイス プラントの冷媒として使用されます。
- 重要な試薬であり、実験室で溶媒として使用されています。
- 家庭用アンモニア、つまり水酸化アンモニウムは、さまざまな表面の洗浄に使用されます。
- 動物性脂肪や植物油による家庭の汚れや染みを分解するのに役立ちます。
- アンモニアは水の浄化に使用されます。
- 爆発物、プラスチック、殺虫剤、布地、染料を製造する際の構成要素として機能します。
アンモニアの検査方法
反応がアンモニアを放出するか、化合物がアンモニアであるかどうかにかかわらず、それを確認するためにいくつかのテストを実行する必要があります.アンモニアの存在を検出するのに役立ついくつかのテストは
1.リトマス試験紙:
アンモニアは塩基性であるため、湿った赤色リトマス紙を青色に変えます。
2.ウコン紙:
アンモニアは、その基本的な性質により、黄色のターメリック ペーパーを茶色に変えます。
3.濃塩酸でテスト:
濃塩酸 (HCl) を 1 滴落とすと、NH4Cl、つまり塩化アンモニウムの濃厚な白い煙が発生します。
4.塩化白金酸:
アンモニアを塩化白金酸で処理すると、黄色の沈殿物が得られます。
H₂PtCl₆ + 2NH₃ → (NH4)₂PtCl₆
5.ネスラー試薬を使用:
ネスラー試薬、つまり K₂HgI₄ のアルカリ溶液で茶色の沈殿物が得られます。
6.硫酸銅溶液の場合:
硫酸銅溶液の場合、アンモニアは濃い青色の溶液になります。
地球外のアンモニアの発生
アンモニアは、太陽系全体に存在することが検出されています。木星や土星のような巨大惑星では、メタン、ヘリウム、水素などの他のガスとともに存在します。アンモニアの凍結結晶が土星の表面で検出されました。
アンモニアは、火星の 2 つの衛星にも存在します。太陽系の小さな物体のアンモニアは、地質学的に重要な不凍特性に従います。これは、アンモニアが水と混合されると、-100°C という低い融点に達するためです。
アンモニアの自然発生
アンモニアは自然界に微量存在します。これは、窒素を含む動物性廃棄物と植物性物質に由来します。腎臓はアンモニアを分泌して過剰な酸の産生を中和します。アンモニアとその塩は、微量の濃度で雨水中にも存在します。重炭酸アンモニウムの結晶は、パタゴニア グアノに存在します。塩化アンモニウム (アンモニア塩) と硫酸アンモニウム (アンモニア塩) は、火山地帯に豊富に存在します。アンモニウム塩は、肥沃な土壌と海水に拡散します。
結論
アンモニアは地表水、地下水、生活排水に自然に存在します。それは主に有機窒素含有化合物の酸化還元と尿素の加水分解によって組み立てられます。水域では、嫌気条件下で硝酸塩を還元することによって自然に存在します。
それはすべての生物にとって重要な窒素源です。それは、生物圏における代謝入力と代謝廃棄物の両方として機能します。地球の大気中、宇宙の巨大惑星の大気中にもアンモニアが検出されています。
よくある質問
1.アンモニアへの曝露は健康に有害ですか?
A. アンモニアは腐食性化合物です。健康への影響の深刻さは、用量、暴露経路、期間によって異なります。
- 空気中の高濃度のアンモニアにさらされると、目、鼻、のど、気道がすぐに火傷します。肺の損傷、失明、または死に至る可能性があります。
- 低濃度のアンモニアを吸い込むと、のどや鼻の炎症や咳を引き起こす可能性があります。
- 通常のアンモニア レベルを消費すると、のど、口、胃にやけどを引き起こす可能性があります。濃アンモニアが目に入ったり皮膚に付着したりすると、やけどや炎症を引き起こす可能性もあります。
2.アンモニアを吸い込んだ後遺症は何ですか?
A. 大量のアンモニアを吸入した場合の最も一般的な症状には、急性の鼻、のど、気道の炎症が含まれます。呼吸困難や呼吸不全を引き起こす可能性があります。大気中のアンモニア濃度が低い場合、のどや鼻への刺激が一般的な副作用です。
3.血液サンプル中の正常なアンモニア濃度は?
A. 血液サンプル中の正常なアンモニア濃度は 15 ~ 45 µ/dL (11 ~ 32 µmol/L) です。通常のアンモニア レベルは次のとおりです。
- 2 歳以上の子供 (酵素):19 ~ 60 mcg/dL
- 生後 10 日~2 歳の幼児および乳児 (酵素):68~136 mcg/dL
- 生後 0 ~ 10 日 (酵素):170 ~ 341 mcg/dL
- 成人:10~80 mcg/dL
テスト結果が通常のアンモニアレベルよりも高いことを示した場合、ライ症候群または肝疾患に苦しんでいる可能性があります.
4.体の大部分がアンモニアにさらされた場合、どのような手順に従う必要がありますか?
A. 体の大部分にアンモニアがこぼれた場合は、所定の手順に従ってください。
- できるだけ早く服を脱ぎ、ビニール袋にしっかりと封をします。
- アンモニアで汚れた衣服が入ったバッグは、他の人の手の届かないところに保管してください。
- 服をすぐに脱げない場合は、カットしてください。
- アンモニアが皮膚にこぼれた場合は、大量の水と石鹸で洗い流してください。
- 必要に応じて、すぐに医療相談を受けてください。